Das künstliche Hüftgelenk ist eine Erfolgsgeschichte, verbessert sie doch die Lebensqualität so mancher Patienten ganz wesentlich und langfristig. So überleben etwa 58 % der künstlichen Hüftgelenke 25 Jahre1. Das Risiko eines Patienten, nach primärer Hüftprothesenimplantation in seinem Leben an der gleichen Hüfte erneut operiert zu werden, ist vor allem altersabhängig und beträgt für einen 70-jährigen Mann um 8 %, für einen 60-jährigen 15 % und für einen 50-jährigen 30 % 2.
Der folgende Artikel will einen kurzen Überblick über die Implantation künstlicher Hüftgelenke in der Schweiz geben, zur häufig bestehenden Unsicherheit bezüglich Zahnarztbesuch von Prothesenträgern die Haltung der Schweizer Orthopäden darlegen, aufzeigen wo in den nächsten Jahren die meisten Fortschritte erwartet werden und woran jeder Arzt denken sollte, wenn ein Hüftprothesenträger über Seh- und Hörstörungen klagt bzw. zentralnervöse Störungen und eine Kardiomyopathie aufweist.
In der Schweiz werden jährlich etwa 18 000 primäre Hüfttotalprothesen implantiert 3. Sie werden in 158 Institutionen durchgeführt, dabei etwa 28 % in 11 Institutionen, welche mehr als 300 primäre Hüftprothesen im Jahr einsetzen, 46 % in 24 Institutionen, welche mehr als 200 im Jahr machen, 81 % in 69 Institutionen, welche mehr als 100 im Jahr machen und 5 % in 66 Institutionen, welche weniger als 50 im Jahr einsetzen. Das mittlere Alter beträgt bei Frauen 68 Jahre, bei Männern 66 Jahre. In 12 % der Fälle sind die Patienten jünger als 45 Jahre, in 6 % älter als 85 Jahre. 39 % der Patienten sind übergewichtig (BMI 25–30), 24 % adipös (BMI > 30). Je höher der BMI, desto jünger sind die Patienten anlässlich der Hüfttotalprothesenimplantation.
Der heute meist verwendete Zugang ist mit 44 % der anteriore, gefolgt vom anterolateralen mit 34 % und vom posterioren mit 15 %. Der vor 10–20 Jahren in Europa und der Schweiz meist verwendete laterale Zugang belegt mit weniger als 10 % den letzten Platz (Abb. 1).
In 85 % der Fälle werden bei primären Hüfttotalprothesen beide Komponenten zementfrei verankert.
Jährlich werden in der Schweiz um die 2500 Hüftprothesen Revisionsoperationen durchgeführt 3. Das mittlere Alter beträgt für Frauen 68 und für Männer 72 Jahre. 3 % der Revisionen betreffen unter 45-jährige, 11 % unter 55-jährige. 12 % betreffen über 85jährige. Die Gründe für die Revision sind nach absteigender Häufigkeit Lockerungen der femoralen und der acetabulären Prothesenkomponente, Infektionen, periprothetische Frakturen und Luxationen.
Im Gegensatz zur primären Prothetik ist bei der Revision der posteriore Zugang mit 33 % der meist verwendete, gefolgt vom lateralen (24 %), anterolateralen (18 %) und anterioren (15 %) Zugang. Bei den Revisionen werden nur noch in 57 % der Fälle beide Komponenten zementfrei verankert.
Hüftprothesen Revisionsoperationen innerhalb von 2 Jahren nach der primären Implantation sprechen für ein technisches Problem. Sie kommen in der Schweiz in 2.2 % der Fälle vor 3. Dabei wird der Grossteil in den ersten 3 Monaten durchgeführt. In 92 % der Fälle werden diese Revisionen in der Institution durchgeführt, welche schon die primäre Operation durchgeführt hat.
Der BMI zeigt einen wesentlichen Einfluss auf die Revisionsrate innerhalb der ersten 2 Jahre. Die Raten erhöhen sich mit der Zunahme des BMI von 1.3 % bei normal gewichtigen zu 2 % bei Übergewichtigen, 3.9 % bei Adipösen, und 6.2 % bei Peradipösen (BMI > 40).
Über alles gesehen sind Infektionen mit 23 % die häufigsten Ursachen für Frührevisionen, gefolgt von periprothetischen Frakturen (21 %) und Luxationen (20 %).
Die periprothetische Fraktur ist bei der Verwendung nicht zementierter Prothesenschäfte doppelt so häufig als bei zementierten Schäften (22 % versus 10 %).
Mikroorganismen der Mund Flora können Gelenkimplantate besiedeln. Transiente Bakteriaemien können nach dem Zähnebürsten, beim Gummikauen, bei der Verwendung von Zahnseide oder gar spontan auftreten. Die Anzahl Bakterien pro Milliliter Blut ist dabei wohl das Entscheidende. So ist eine gute Mundhygiene nachgewiesenermassen mit einem niedrigeren Risiko einer periprothetischen Infektion vergesellschaftet. Entsprechend ist eine Zahnuntersuchung vor der Implantation eines künstlichen Gelenkes bei Patienten, welche nicht in regelmässiger zahnärztlicher Behandlung stehen, empfehlenswert und sollte potentielle Infektionsherde nachweisen und behandeln sowie Patienten bezüglich Mundhygiene und Infektionsrisiko sensibilisieren.
Unbestritten ist, dass bei einem Prothesenträger eine Infektion in der Mundhöhle, beispielsweise ein Abszess oder eine apikale Periodontitis, immer antibiotisch behandelt werden soll, da sehr hohe Bakterienkonzentrationen im Blut erwartet werden. Zum Beispiel Amoxicillin / Clavulanate 1 g alle 8 Stunden oder Clindamycin 600 mg alle 8 Stunden für 3–5 Tage.
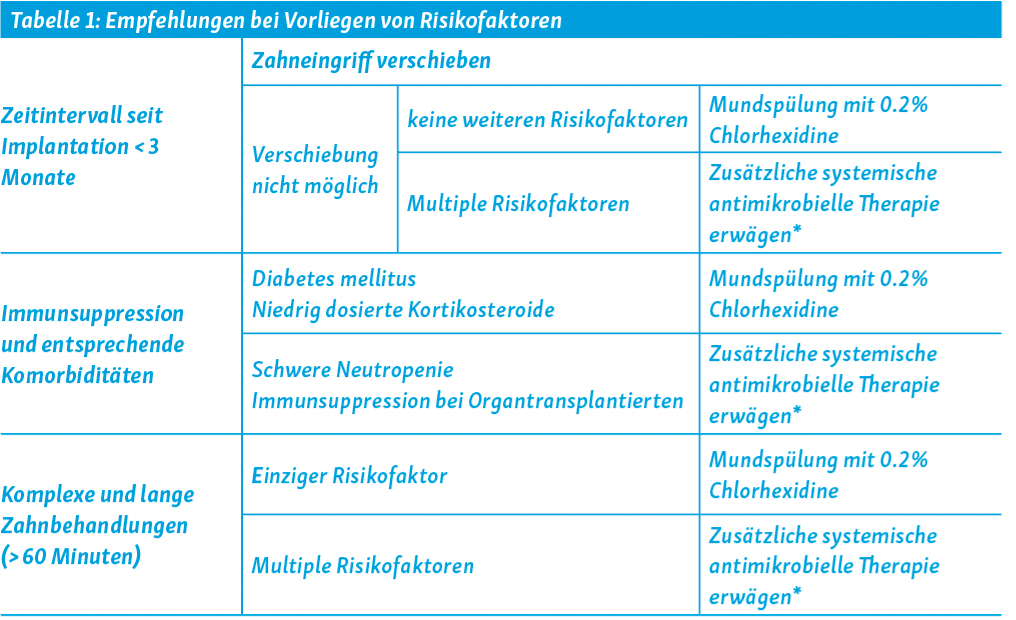
Nicht jedoch bei einer routinemässigen zahnärztlichen Behandlung. Aus folgenden epidemiologischen Überlegungen wird das Risiko einer hämatogenen periprothetischen Infektion nach zahnärztlichem Eingriff ohne Infekt in der Mundhöhle als kleiner 0.1 % eingeschätzt: Bei einer Inzidenz periprothetischer Infektionen von 0.7 bis 1.4 % ist der Anteil, welcher durch Keime aus der Mundflora verursacht wird, kleiner als 4 %. Das bedeutet, dass auf 10 000 Prothesenträger 3–10 einen periprothetischen Infekt mit Keimen aus der Mundflora erleiden. Dabei ist der Anteil, welche ohne zahnärztlichen Eingriff eine solche Infektion erleiden, unbekannt. Das heisst, dass nur ein Teil von ihnen von einer antimikrobiellen Prophylaxe anlässlich des Zahnarzttermins profitieren würden. Selbst wenn dadurch 80 % der Infektionen verhindert werden könnten, würde das bedeuten, dass 1250–4167 Prothesenträger behandelt werden müssten, um eine einzige periprothetische Infektion zu verhindern. Demgegenüber stehen Resistenzentwicklung und Nebenwirkungen in keinem Verhältnis. Mundspülungen mit 0.2 % Chlorhexidine ist die einzige empfohlene prophylaktische Massnahme. Als Risikogruppen für eine hämatogene periprothetische Infektion gelten Patienten, welche das Hüftimplantat vor weniger als 3 Monate erhalten haben, immunsupprimierte Patienten mit entsprechenden Komorbiditäten und Patienten, welche einen langen Zahneingriff benötigen (arbiträr > 1 Stunde). Diese Risikogruppen basieren nicht auf medizinischer Evidenz. Für diese Risikogruppen hat die Expertengruppe Infektionen der schweizerischen Gesellschaft für Orthopädie und Traumatologie, Swiss Orthopaedics, einen Konsens formuliert, der in Tabelle 1 zusammengefasst ist.
Die Hüftprothetik hat seit ihrer Einführung in der Mitte des 20. Jahrhunderts eine eindrückliche Entwicklung durchgemacht. Während in den frühen Jahren erhebliche Verbesserungen der Implantate bezüglich Funktionalität, Abriebresistenz und Standzeiten erreicht wurden und in den letzten 10 bis 20 Jahren die chirurgische Technik durch weniger invasive Zugänge verbessert wurde, wird heute der Fortschritt im perioperativen Management gesucht: «rapid recovery» ist das neue Schlagwort. Ziel dabei ist es, durch eine Verbesserung aller Aspekte der Behandlung die Erholung des Patienten zu optimieren. Eine Folge davon ist, dass Patienten heute nach der Implantation einer primären Hüftprothese sehr viel schneller mobil und selbständig sind, was eine wesentliche Verkürzung des Krankenhausaufenthaltes erlaubt. In einigen Ländern, insbesondere den USA und auch in Nordeuropa werden heute Hüfttotalprothesen ambulant implantiert.
Dazu ist ein multidisziplinäres Zusammenspiel von zahlreichen Elementen notwendig: adäquate präoperative Patienteninformation, intraoperative, chirurgische und anästhesiologische Elemente, frühpostoperative Mobilisation, optimale postoperative Schmerzmedikation und Organisation der Phase nach dem stationären Aufenthalt.
Präoperativ sollen die Patienten möglichst genau über den gesamten Behandlungsablauf informiert werden. Insbesondere muss die Phase nach der Hospitalisation, auch unter Einbezug des sozialen Umfeldes des Patienten, organisiert werden. Durch Hospitalisation erst am Operationstag soll die Zeit, in welcher der Patient von seiner gewohnten Umgebung entfernt ist, verkürzen. Einer Optimierung des Patienten bezüglich Anämie, Eisenmangel und Eiweissmangel kommt diesbezüglich eine grosse Bedeutung zu. Gewebeschonende minimalinvasive Techniken sind heute Standard und ermöglichen eine frühe Mobilisation mit wenig Restriktionen. Meist können die Patienten von Beginn weg voll belasten. Eine sorgfältige Blutstillung soll Drains obsolet machen und das standardmässig systemisch verabreichte Antifibrinolytikum Tranexamsäure kann, wie in zahlreichen Studien belegt, erheblich die intra- und frühpostoperative Blutung vermindern. Die Infiltration des Operationsgebietes am Ende der Operation mit einem lang wirksamen lokalen Anästhetikum kombiniert mit Adrenalin und einem nicht steroidalen Entzündungshemmer erleichtert die frühe Mobilisation am Operationstag und vermindert den systemischen Schmerzmittelgebrauch mit all seinen ungünstigen Nebeneffekten. Limitierend sind dabei gelegentlich orthostatische Probleme, seltener eine ungenügende Analgesie.
Zur Verminderung der systemischen entzündlichen Reaktion, die bei allen chirurgischen Eingriffen beobachtet wird, werden bereits während der Operation intravenös Steroide (z. B. Dexamethason) verabreicht und postoperativ wiederholt. Der physiotherapeutisch begleiteten Mobilisation kommt in den ersten Tagen eine zentrale Bedeutung zu. Während Verlängerungen der geplanten Hospitalisation aus nicht-medizinischen Gründen vermieden werden sollten, muss das Risiko einer Rehospitalisation aufgrund von Komplikationen auf ein Minimum reduziert werden. Studien über ambulante Hüftprothetik zeigen, dass dies möglich ist 5,6. Regionale sozio-ökonomische Aspekte sowie Erwartungen von Patienten dürfen jedoch auf keinen Fall vernachlässigt werden.
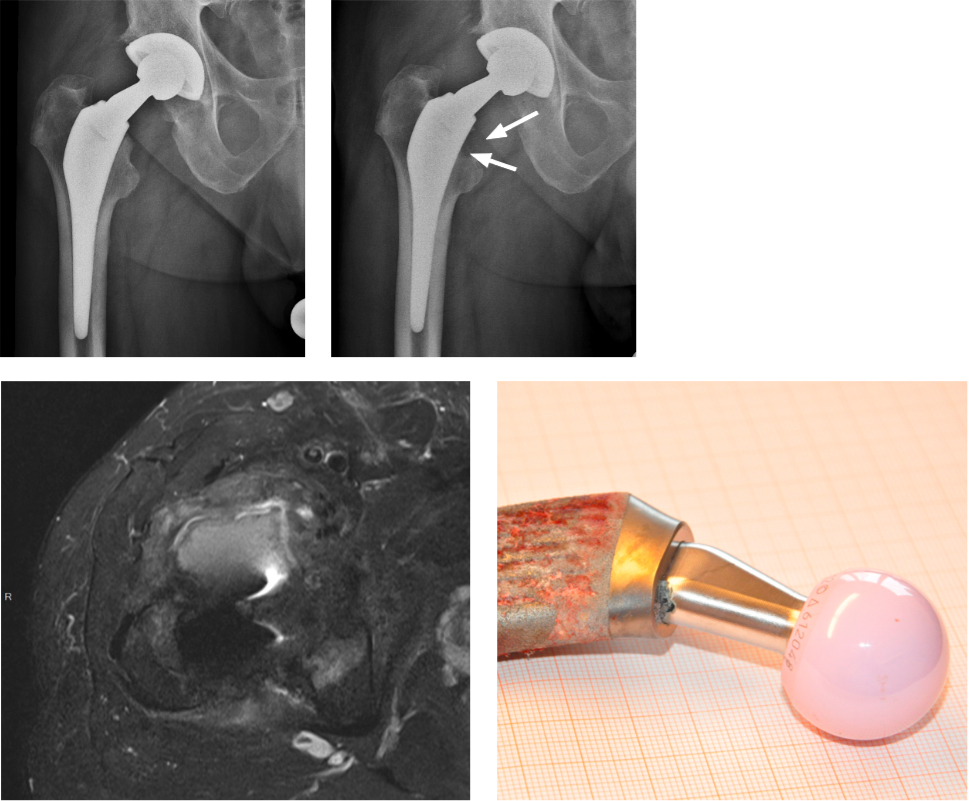
Seh-, Hör- und andere zentralnervöse Störungen sind Zeichen einer Kobalt Vergiftung und können über eine Kardiomyopathie und einem Multiorganversagen lebensbedrohlich sein. Bereits ganz früh in der Entwicklung der Hüftprothetik sind Metall-Legierungen aufgrund ihrer mechanischen und chemischen Stabilität und Verträglichkeit verbreitet zum Einsatz gekommen. Sie sind heute nicht mehr weg zu denken. Hauptsächlich getriggert durch eine sehr hohe Revisionsrate bei einigen Fabrikaten von Oberflächenprothesen («Hüftkappen») hat das Interesse und Verständnis von Metall-assoziierten Problemen in der Hüftprothetik in den letzten zehn Jahren sehr stark zugenommen. Die hohe Versagerraten dieses Prothesentypes, bei dem eine Metall-Kappe auf dem Femurkopf mit einer dünnwandigen Metall-Pfanne (CoCr) artikuliert, konnte auf lokal toxische Prozesse zurückgeführt werden. Obwohl dieser Abrieb vom Volumen her im Vergleich zu herkömmlichen Metall-auf-Polyethylen sehr klein ist, kann es zu einer Freisetzung von beträchtlichen Mengen von Kobalt- und Chrom-Ionen kommen. Vor allem Kobalt kann eine schwere lokale und systemische Toxizität entfalten. Während das Spurenelement Kobalt essentiell für den normalen Zellmetabolismus ist, kann es in hoher Konzentration zu Apoptose, Nekrose und DNA-Schäden führen 8.
Hüft-Oberflächenprothesen sind jedoch nicht die einzigen Implantate, die metall-assoziierte Probleme verursachen. Alle Hüft-Totalprothesen, bei welchen eine Metall-Metall- Gleitpaarung verwendet wird, können solche Komplikationen verursachen. Des Weiteren können Korrosionsschäden an modularen Steckverbindungen zwischen Prothesenkomponenten (z. B. zwischen Schaft und Kopf) durch vermehrte Kobalt Freisetzung einen frühzeitigen Prothesenwechsel notwendig machen. Das Risiko ist erhöht, wenn zum Beispiel verschiedene Legierungen modular kombiniert werden, oder die Steckverbindungen mechanisch ungünstig belastet werden. Die grösste diesbezügliche Altlast sind Hüftprothesenträger, welche wegen einer Keramikfraktur mit einer Metall-Metall oder Metall-Polyethylen-Gleitpaarung revidiert wurden. Letzteres wurde zusammen mit einer totalen Kapselresektion 2010 noch beschrieben. In der Hüfte verbleibende Keramikpartikel können dadurch, dass sie zwischen Metallkopf und Pfanne zu liegen kommen, den Kopf abreiben und so zu Kobaltkonzentrationen im Blut führen, welche 10 bis 2000 fach erhöht sind 9.
Die Freisetzung von Metall-Ionen können lokale Weichteil- und Knochenschäden verursachen, welche dann zu Lockerungen der Implantate führen. Zum Teil werden metall-induzierte reaktive Weichteilveränderungen beobachtet, welche lokales Muskel-, Sehnen und Knochengewebe schädigen («Pseudotumore»). Insgesamt sind systemische metall-induzierte Probleme sehr viel seltener als lokale Komplikationen. Folgende systemische Symptome wurden mit einer Implantatinduzierten Cobalt-Vergiftung in Verbindung gebracht: periphere Neuropathie, Tinnitus, Hörstörungen, Depression, Kardiomyopathie, Visusverschlechterung bis zur Erblindung. Ein erhöhtes Krebsrisiko bei Patienten mit Metall-Metall-Gleitpaarungen konnte jedoch in grossen nationalen Registerstudien weitgehend ausgeschlossen werden 8, 10. Da Patienten sehr lange symptomfrei oder beschwerdearm bleiben können, ist die frühzeitige Diagnose von Metall-assoziierten Problemen häufig schwierig. Von verschiedenen Fachgesellschaften wurden in den letzten zehn Jahren daher zahlreiche Screening-Algorhythmen vorgeschlagen, wie Patienten mit solchen Implantaten nachkontrolliert werden sollten. Praktisch alle Empfehlungen basieren auf der Symptomatik, Kobalt- und Chrom-Ionenkonzentrationen im Serum, Röntgenbildern sowie weiterführender Bildgebung (MARS-MRI, Computertomographie, Ultraschall), um verdächtige Weichteilschäden frühzeitig zu erfassen. Zudem wurden verschiedene Risikofaktoren, welche eine Metallionen-Freisetzung begünstigen, identifiziert. Dazu gehört zum Beispiel eine zu hohe Inklination der Pfanne (über 50°), oder auch gewisse Prothesentypen, welche mit sehr hohen Revisionsraten assoziiert waren. Durch Bestimmung solcher Risikofaktoren kann das Screening von Patienten risikoadaptiert festgelegt werden. Einen internationalen Konsens über die Art der Nachkontrollen von Patieten mit Metall-Metall-Gleitpaarungen konnte sich jedoch bis heute nicht durchsetzen. Bei sehr hohen Ionenkonzentrationen empfiehlt sich eine Abklärung betreffend systemische Toxizität (neurologische und kardiologische Bilanzierung).
Bei steigenden oder hohen Konzentrationen von Kobalt im Serum ist eine orthopädische Beurteilung angebracht. In der Regel ist die Eliminierung der Ionenquelle indiziert, was einen Wechsel der Gleitpaarung (zum Beispiel auf Keramik-Polyethylen) nötig macht. Häufig sind solche Prothesenwechsel komplex, da bereits ausgedehnte Knochen- und Weichteilschäden vorliegen.
Referenzen
- Evans JT et al. The Lancet 2019; 393: 647
- Bayliss LE et al. The Lancet 2017; 389: 1424
- Annual Report of the Swiss National Joint Registry, Hip and Knee, 2012–2016
- Sendi P et al. J. bone Joint Infect. 2016; 1: 42
- Hoffmann JD et al. J Arthroplasty 2018; 33:1265
- Vehmeijer SBW et al. Acta Orthop 2018; 89:141
- Cheung AC et al. Bone Joint J 2016;98-B:6
- Mäkelä KT et al. Acta Orthop 2014; 85:32–8
- Harris A et al. Arthroplasty Today 2015; 1: 89
- Hunt LP et al. PLoS One 2018; 13(9): e0204356

