Hintergrund: Knorpelschäden an der Hüfte können verschiedene Ursachen haben. Analog zu anderen Gelenken sind traumatische, chronische oder degenerative Prozesse als Ursache erkennbar. Die Inzidenz traumatischer Knorpelschäden an der Hüfte ist relativ gering. Als eine der Hauptursachen für die Entwicklung einer (osteo-)chondralen Läsion ist bei jüngeren Patienten unter 40 Jahren neben der residuellen Hüft-Dysplasie vor allem das femoro-acetabuläre Impingement (FAI) zu nennen.1 Unbehandelt können diese Entitäten zu einer frühen sekundären Osteoarthrose führen. Die Behandlung der Dysplasie oder FAI zielt darauf ab, das Gelenk zu stabilisieren und abnorme Kontaktbelastungen zu reduzieren2–4, womit letztlich die Entwicklung der Arthose verzögert werden kann.
Neben der Therapie der Grunderkrankung ist begleitend häufig ein knorpel-reparativer Eingriff erforderlich. Die meisten Knorpelreparaturtechniken haben ihren Ursprung in der Behandlung von Läsionen im Knie. Aufgrund der engen knöchernen Führung des Kugelgelenks und der Weichteildeckung bleibt die Behandlung von Knorpelläsionen der Hüfte eine Herausforderung. Hüftarthroskopie und chirurgische Hüft-Luxation sind im Vergleich zum Knie technisch komplexer und invasiver. Daher muss die geeignete Knorpelreparaturtechnik sorgfältig in Abhängigkeit von Alter, Defekt-Lokalisation und -Ausmass sowie Begleitläsionen ausgewählt werden.
Ein knorpel-reparativer Eingriff kann jedoch nur langfristigen Erfolg zeigen, wenn die zum Schaden führende Pathologie adäquat behandelt wird. Dies bedeutet, z. B. beim Impingement die mechanische Pathologie des Offsets zu beheben bzw. das Labrum wieder zu stabilisieren. Bei der Dysplasie beinhaltet es das Schaffen einer suffizienten Überdachung des Femurkopfes. Die Wahl der Operationsmethode beim Impingement scheint das subjektive Langzeit-Ergebnis des Patienten nicht zu beeinflussen. So zeigen die Ergebnisse der Arthroskopie vergleichbare Resultate zu der chirurgischen Hüft-Luxation, wobei die initiale Komplikations- und Revisionsrate der letzteren Methode im Verlauf klar höher liegt.6
Anamnese und Klinik
Die meisten Patienten, welche von einem FAI oder einer Dysplasie betroffen sind, werden aufgrund von Beschwerden im Alter zwischen 20 und 30 vorstellig. Hierbei finden sich in der Regel bereits strukturelle Schäden am Labrum, welche in bestimmten Positionen oder unter Provokationstests mit einschiessenden inguinalen Schmerzen einhergehen. Reine Knorpelschäden präsentieren sich klinisch sehr heterogen und sind in der Untersuchung nicht sicher zu identifizieren.7 Häufig entstehen die Schmerzen erst durch eine reaktive Synovitis oder ein Begleit-Ödem des subchondralen Knochens, was auch spätere Ruhe- oder Nachtschmerzen erklären kann.
Bildgebende Verfahren
Grundlage der Diagnostik ist die standardisierte a.p.-Aufnahme des Beckens inklusive einer 2. Ebene. Anhand dieser lässt sich häufig die zugrundeliegende mechanische Pathologie sowie das Ausmass der degenerativen Veränderung erkennen. Bei Bedarf können weitere Spezialaufnahmen (z. B. Faux-Profil, Abduktionsaufnahmen) zur Operationsplanung ergänzt werden. Hierauf aufbauend kann bereits ein primäres therapeutisches Konzept erstellt werden. Zur genauen Beurteilung der intra- und periartikulären Situation ist eine Arthro-MRI mit einer empfohlenen Mindest-Feldstärke von 1.5 T erforderlich. Ein fokussiertes Arthro-MRI speziell der Hüfte ist in seiner Aussagekraft einem reinen Becken-MRT klar überlegen. Mittels knorpelsensitiver MRI-Sequenzen lässt sich neben der Lokalisation das exakte Ausmass des Knorpelschadens exakt erfassen.8 Weiterhin können zusätzliche Pathologien, z. B. des Labrums, der Synovia oder des Knochens sowie auch die Rotationsverhältnisse beurteilt werden.
Klassifikation von Knorpeldefekten
Eine genaue Kenntnis der Lokalisation sowie des Ausmasses des Knorpelschadens ist unerlässlich für eine korrekte Therapieplanung sowie eine postoperative Beurteilung. Folgende Teil-Aspekte sollten hierbei beachtet werden: Lokalisation, Grösse und Tiefen-Ausdehnung des Defektes, subchondraler Knochen sowie der chondro-labrale Komplex. Die bekannte ICRS-Klassifikation von Knorpelschäden ist bislang für die Hüfte nicht validiert.
Zur Klassifikation der Defekt-Morphologie wird einerseits die Klassifikation nach Beck verwendet.9 Ergänzt um die anatomische Defektzuordnung kann andernfalls die Klassifikation nach Haddad (Tab. 1) verwendet werden, welche im Rahmen einer Hüftarthroskopie erhoben werden kann.5

Für die Beschreibung der Defektlokalisation hat sich in der Praxis die Beschreibung nach der «Uhrzeiger-Methode» bewährt (Abb. 1).
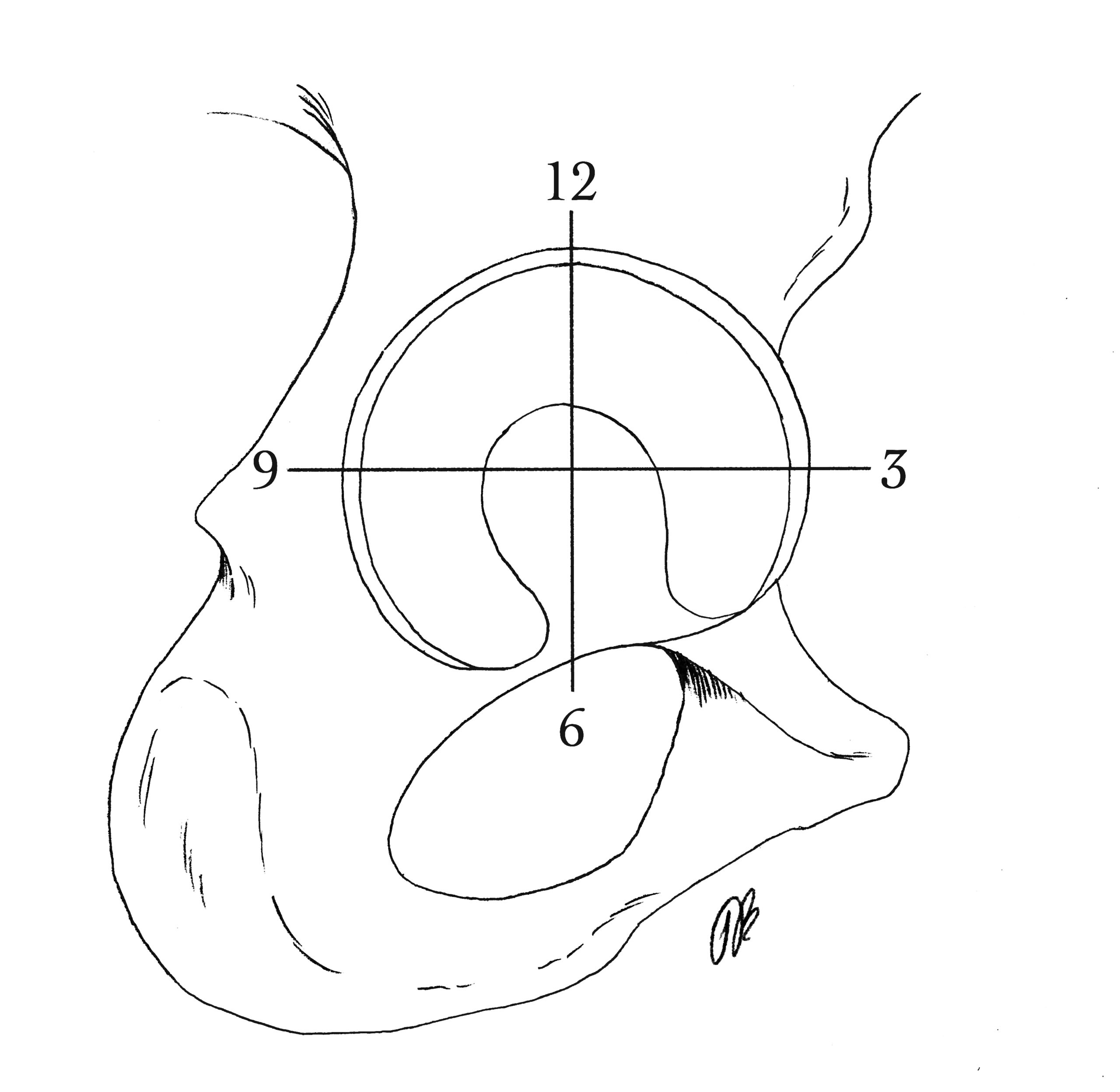
Hierbei werden das Acetabulum, bzw. der Femurkopf in Sektoren wie auf einem Ziffernblatt eingeteilt, was eine exakte und reproduzierbare Beschreibung der Lokalisation ermöglicht. Initial wurde diese Methode von Leunig et. al. 1997 im Rahmen der MRI Diagnostik von Labrumläsionen eingeführt.10 Später übertrug Philippon diese Methode auf die arthroskopische Beschreibung von acetabulären Läsionen.11
Techniken und Verfahren
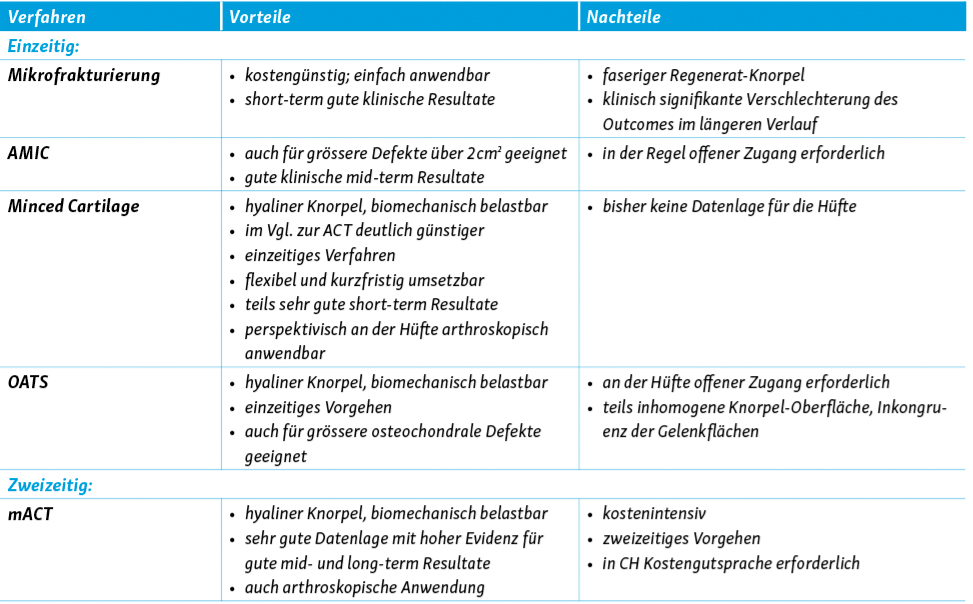
Zur Therapie eines Knorpelschadens stehen grundsätzlich 2 verschiedene Therapie-Optionen zur Verfügung: a) knochenmark-stimulierende Techniken wie Mikro- (MFx) oder Nano- Frakturierung (NFx) oder b) transplantierende Techniken wie z.B. die autologe Chondrozyten-Transplantation (ACT).12 Bei osteochondralen Defekten, welche tendentiell häufiger femoral auftreten, ist im selben Eingriff eine begleitende ossäre Rekonstruktion, z. B. mittels Spongiosaplastik oder auch mittels osteochondralem Transplantat, erforderlich. Nach der Wahl des geeigneten Operationsverfahrens ist allen Varianten gleich, dass zunächst das Defektareal adäquat debridiert, d.h. von pathologisch verändertem Knorpel- oder Bindegewebe befreit wird, so dass die subchondrale Grenzlamelle dargestellt wird. Dies sollte unter Herstellen einer stabilen, den Defekt zirkumferent umgebenden Randzone aus gesundem Knorpelgewebe erfolgen.
Alle oben genannten Verfahren benötigen ein ausreichendes knöchernes Containment. Das bedeutet, dass die subchondrale Grenzlamelle intakt sein sollte. Im Falle eines knöchernen Defektes im Sinne einer osteochondralen Läsion bedarf es zeitgleich eines additiven Verfahrens zur Defektdeckung. Dies kann einerseits eine allogene/autogene Spongiosaplastik sein oder auch eine Mosaikplastik wie bei einem osteochondralen autologen Transplantations-System (OATS).
Bereits in den 80er Jahren gab es Fallbeschreibungen, in welchen die Autoren versuchten, delaminierende Knorpeldefekte oder freie chondrale Fragmente nur mittels Fibrinkleber oder Nahttechniken wieder zu refixieren.13, 14 Allerdings zeigten sich die klinischen Ergebnisse keineswegs zufriedenstellend, die refixierten Knorpelanteile wiesen kein ausreichendes Potential für eine erneute Knorpel-Reifung auf und verloren ihre mechanische Stabilität. In der jüngsten Studie aus dem Jahr 2020 konnten Leunig et. al. zeigen, dass Chondrozyten aus refixierten Knorpelflaps nicht genügend chondrogene Kapazität aufweisen, ausreichend extrazelluläre Matrix zu bilden.15
2015 wurden erstmals klinische Daten einer Studie präsentiert, in welcher Knorpel aus einer Defektzone am Knie in kleinstmögliche Stücke fragmentiert und anschliessend in die Defektzone reimplantiert wurde. Dieses am Knie mittlerweile als «minced cartilage» oder «Knorpelfragmentations-Plastik» gut etablierte Verfahren zeigt eine gute Maturation des transplantierten hyalinen Knorpels mit bis dato guten Ergebnissen bei jedoch kurzem Beobachtungszeitraum.16 Anhand bio-histochemischer Studien konnte gezeigt werden, dass die Fragmentation eine erneute Migration und Maturation der Chondrozyten bewirkt, letztlich die Vitalität in den Fragmenten nicht kompromittiert wird.17, 18 Für die Hüfte existieren bis dato keine Daten, das Verfahren könnte aber zukünftig aufgrund der sofortigen Verfügbarkeit, geringen Kosten und arthroskopischen Anwendbarkeit eine grössere Rolle spielen.
Mikrofrakturierung und Autologe Matrix-induzierte Chondrogenese (AMIC)
Die Indikation für eine Mikrofrakturierung (MFx) liegt in der Hüfte bei teil- oder vollschichtigen Knorpeldefekten mit einer Grösse bis zu 2.0 cm2. MFx beinhaltet das Eindringen in die subchondrale Knochenplatte mittels speziell gekrümmten Knochenahlen. Hierdurch können mesenchymale Stammzellen, Wachstumsfaktoren und Zytokine aus dem Knochenmark in den Defekt eindringen, wo sie zu einem Thrombus gerinnen und die Entwicklung eines Faserknorpels fördern. Zwischen den einzelnen Bohrungen sollte ein Abstand von ca. 4 mm eingehalten werden, die Eindringtiefe hierbei ca. 5 mm betragen (Abb. 2 a–d).19
Technisch ist es schwierig, eine einheitliche Eindringtiefe der Bohrlöcher zu erzielen. Dies liegt zum einen daran, dass die acetabulären Knorpeldefekte häufig stark sklerosieren. Zum anderen müssen die Instrumente häufig in einem nahezu orthogonalen Winkel zur gewünschten Bohrrichtung eingebracht werden. Dies führt dazu, dass die Instrumente (Ahle oder Bohrer) teilweise aus der Achse abweichen und eine Riefe oder Kerbe generieren.
Der durch MFx entstandene Faserknorpel zeigt nicht die gleiche biomechanische Belastbarkeit wie hyaliner Knorpel. Bezüglich des Kniegelenks gibt es eine recht umfassende Datenlage, welche bei Behandlung eines Knorpelschadens mit MFx eine signifikante klinische Verschlechterung im Verlauf nach etwa 2–5 Jahren beschreibt.20, 21 Weiterhin kann die im Rahmen der MFx durchgeführte Perforation der subchondralen Grenzlamelle zu einer ossären Pathologie wie einer Sklerose, Zyste oder intraläsionalen Osteophyten im Verlauf führen.22, 23 Mittlerweile sind am Knie die meisten Operateure dazu übergegangen, die Mikrofrakturierung in gebohrter Technik als sogenannte Pridie-Bohrung durchzuführen. Einerseits ist im direkten Vergleich zur MFx eine geringere Anzahl an Bohrungen erforderlich, was mit einer geringeren Traumatisierung der Grenzlamelle einhergeht. Weiterhin lässt sich durch die tiefere Bohrung ein quantitativ höherer Einstrom an mesenchymalen Stammzellen (MSC) aus dem Knochenmark hervorrufen, was mit einem besseren Knorpelregenerat assoziiert wird.
Da das Fibringerinnsel mechanisch nicht stabil genug ist, um den Scherkräften über einen längeren Zeitraum standzuhalten, wurde die autologe matrixinduzierte Chondrogenese (AMIC) als verbesserte Technik entwickelt.24 Dieses einzeitige Verfahren kombiniert die Mikrofrakturierung mit der Abdeckung des behandelten Areals mit einer zweischichtigen Kollagen-Membran (Chondro-Gide®, Geistlich Pharma AG; Wolhusen, Schweiz), welche verhindert, dass die Vorläuferzellen in das Gelenk diffundieren und das behandelte Areal vor mechanischer Beanspruchung schützen. Je nach Defektgrösse und Lokalisation kann eine AMIC ggf. arthroskopisch durchgeführt werden. Bei grösseren Defekten oder schwer erreichbaren Lokalisationen empfiehlt sich jedoch ein offenes Verfahren mittels chirurgischer Hüft-Luxation (Abb. 3).
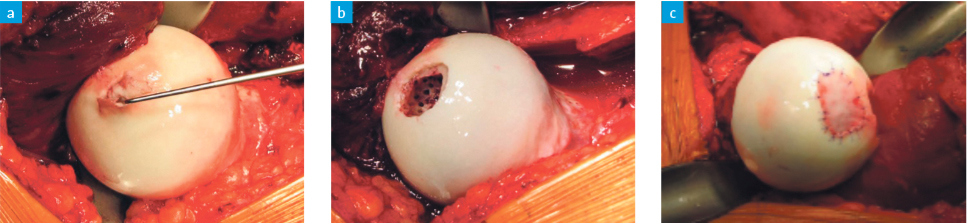
a) Tasthaken sondiert die Delamination des Knorpels
b) Debridiertes und mikrofrakturiertes Areal
c) In die aufbereitete Defektzone aufgetragene Chondro-Gide Membran®, mit resorbierbarem Faden zirkumferent fixiert
Die Fixation der Membran kann mittels Fibrinkleber oder mit offener Naht mit resorbierbarem Nahtmaterial erfolgen, wobei die bisherige Datenlage aus dem Kniegelenk keine klare Überlegenheit einer Fixations-Technik zu zeigen scheint. Die Indikation für ein AMIC-Verfahren kann im Gegensatz zur MFx auch auf vollschichtige Knorpeldefekte von mehr als 2.0 cm2 erweitert werden.
Unverändert ist die arthroskopische Mikrofrakturierung der am häufigsten an der Hüfte durchgeführte knorpelreparative Eingriff. Im Vergleich zum Knie ist die existierende Datenlage für die Hüfte aufgrund des kleineren Erfahrungshorizonts deutlich geringer. Ein systematisches Review bezüglich MFx nach Hüft-Arthroskopie beschreibt überwiegend positive Resultate bei niedrigem Evidenzlevel. Die untersuchten 12 Studien zeigen insgesamt ein durchschnittliches Follow-up von 29 Monaten bei eher geringen Fallzahlen und ohne Kontrollgruppen.25 Bei zwei weiteren Studien-Kohorten mit geringer Fallzahl (n=9; n=17) wurde innerhalb von 20 Monaten erneute Hüft-Arthroskopien durchgeführt. Hier wurde jeweils rein morphologisch-deskriptiv eine Defektauffüllung zu ca. 90 % beschrieben.26, 27
Bezogen auf Knie und Sprunggelenk zeigen die bestehenden Daten für das AMIC-Verfahren zufriedenstellende Ergebnisse für die Behandlung von (osteo-) chondralen Läsionen im mittelfristigen Follow-up.28–30 Daten aus der italienischen Arbeitsgruppe um Girolamo und Fontana zeigen, dass sich auch nach 5 Jahren31 und 8 Jahren32 gute klinische Resultate in den PROM-Scores nach der Behandlung mittels AMIC zeigen lassen. Neueste Daten stützen die Feststellung einer Verschlechterung der MFx nach 1–2 Jahren Nachuntersuchung in der Hüfte. Darüber hinaus zeigen sie, dass AMIC im direkten Vergeich zur MFx nach 5 bis 8 Jahren Follow-up ein stabiles klinisches Zwischenergebnis liefert.33
Autologe Chondrozytentransplantation (ACT)
Neben den bereits besprochenen stimulierenden Verfahren (MFx / AMIC) existieren auch Techniken, bei welchen Knorpelgewebe transplantiert wird. Herausragenden Stellenwert besitzt hierbei die autologe Chondrozyten-Transplantation, welche am Knie bei entsprechender Indikation gute klinische Ergebnisse auch im mittel- und langfristigen Verlauf zeigt. Anderweitige Techniken wie OATS (Osteo-Chondrales Autologes Transplantations-System) oder Allografts haben an der Hüfte quantitativ einen geringeren Stellenwert. Die Indikation für eine ACT ist bei einem vollschichtigen Knorpelschäden ab 2.0 cm2 gegeben. Das Grundprinzip besteht darin, zunächst aus einem wenig belasteten Bereich des Gelenks in einem ersten Eingriff Knorpelgewebe zu gewinnen. Dieses wird in vitro amplifiziert und als Verfahren der 3. Generation auf eine Kollagen-Matrix aufgetragen. Diese wird im Folgeeingriff in die debridierte Defektzone eingebracht und fixiert. Dieses matrix-basierte Verfahren (MACT) birgt einige Vorteile gegenüber den Verfahren der 1. und 2. Generation, in welchen mit einer Zell-Suspension gearbeitet wurde.34, 35
Trotz der teils sehr guten klinischen Ergebnisse der ACT erscheinen die matrix-basierten Verfahren für die arthroskopische Technik als noch nicht ideal. Technisch gestaltet es sich schwierig, bei der Arthroskopie die dicht mit Chondrozyten besiedelte Matrix eingerollt durch einen Trokar in das Gelenk zu bringen. Diese biomechanische Belastung kann zu einer Kompromittierung der Zell-Vitalität bis hin zum Absterben der Chondrozyten führen mit entsprechend schlechteren klinischen Ergebnissen.36 Weiterhin gilt es allgemein bei der ACT zu bedenken, dass es zwei konsekutive Eingriffe in etwa 28 Tagen Abstand erfordert. Im Gegensatz zu anderen Verfahren bedarf es aktuell in der Schweiz unverändert einer Kostengutsprache seitens des Versicherungsträgers, welche nicht immer gewährt wird.
Technische Weiterentwicklungen machen mittlerweile eine injizierbare Anwendung der ACT möglich. Hierbei können die kultivierten Chondrozyten als sog. Chondrosphären oder in Hydrogelen arthroskopisch appliziert werden.
Bezüglich der ACT existiert für das Knie mittlerweile eine grosse Datenlage mit teils hoher Evidenz. Dies beinhaltet auch prospektiv randomisierte Studien und systematische Reviews, anhand derer gute klinische Ergebnisse im Langzeitverlauf beobachtet werden.37, 38 Die verfügbare Datenlage zum Hüftgelenk ist derzeit noch geringer. Erste Ergebnisse aus dem Jahr 2012 einer retrospektiven Studie zeigten in einem kleinen Kollektiv (n=15) eine klare klinische Verbesserung nach 5 Jahren zur Vergleichsgruppe, welche nur ein Débridement erhielt.39 In einer weiteren retrospektiven, ebenfalls nicht randomisierten Studie aus dem Jahr 2014 wurden die Ergebnisse der ACT mit denen der AMIC nach 5 Jahren verglichen. Dieses Kollektiv wurde aufgrund eines acetabulären Knorpelschadens aufgrund eines FAI behandelt. In den Score-basierten Daten konnten beide Verfahren 5 Jahre nach Operation eine klare Verbesserung zeigen, wenn aber auch aufgrund des Studien-Designs und der fehlenden bildgebenden Kontrolle keine hohe Evidenz vorliegt.31 Die Datenlage für injizierbare ACT-Formen fällt nachvollziehbarerweise noch gering aus. Allerdings zeigen die bisherigen Studien bis dato überwiegend gute frühe klinische Ergebnisse.40, 41
Indikation und Verfahrenswahl
Unabhängig vom verwendeten Verfahren muss die Entscheidung für einen knorpelreparativen Eingriff vom Ausmass degenerativer Veränderungen abhängig gemacht werden. Während einige Autoren die Indikation erst bei fortgeschrittenen degenerativen Veränderungen Tönnis II° kritisch sehen, so empfehlen die Autoren bereits eine kritische Prüfung der Indikation bei einer gegebenen Verschmälerung des Gelenkspaltes. Grundsätzlich liegt die Empfehlung für einen gelenkerhaltenden Eingriff eher bei jungen, sportlich aktiven Patienten. Die Wahl des geeigneten Verfahrens (MFx / AMIC / ACT) richtet sich dann nach Grösse sowie Lokalisation des Defektes und seiner Erreichbarkeit mit der geeigneten Methode. Wie erwähnt bieten sich knochenmarkstimulierende Verfahren (MFx / AMIC) bis zu einer Defektgrösse von 2.5 cm2 an. Bei grösseren Defekten kann, sofern verfügbar, die Indikation für eine ACT geprüft werden.
Wie eingangs erwähnt, ist ein knöchernes Containment unabdingbar. Im Falle eines zusätzlichen knöchernen Defektes ist eine additive Behandlung wie z.B. in Sinne einer Spongiosaplastik oder ein transplantierendes Verfahren mittels einer OATS erforderlich.
AMIC weist im Vergleich zur ACT einige Vorteile auf: einerseits handelt es sich um ein einzeitiges Verfahren, bei welchem kein Voreingriff zum Knorpelgewinn erforderlich ist. Weiterhin ist AMIC im Vergleich zur ACT sehr kostengünstig und bedarf in der Schweiz keiner Kostengutsprache. Anhand der bisherigen Datenlage lässt sich erkennen, dass eine Behandlung mit AMIC im Vergleich zur MFx auch stabile klinische Ergebnisse im mittelfristigen Verlauf zeigt.32
Nachbehandlung
Unabhängig von der Verfahrenswahl erfolgt meistens eine Teilbelastung von 15–20 kg der betroffenen Extremität unter Thromboseschutz. Teilweise wird die Verwendung einer CPM-Motorschiene für die ersten Tage postoperativ empfohlen. Im Rahmen der Physiotherapie sollte eine isometrische Beübung der Muskulatur erfolgen. Die Aussagen bezüglich return-to-sport sind sehr heterogen. Die Autoren empfehlen in Abhängigkeit von der Sportart und dem individuellen Trainingszustand ein Intervall von ca. 3–6 Monaten. High-impact Aktivitäten oder Kontaktsportarten sollten nicht vor Ablauf von 12 Monaten postoperativ durchgeführt werden.
Konklusion
Wie bei jedem chirurgischen Verfahren muss im Vorfeld eine klare Abwägung der Vor- und Nachteile eines jeden Verfahrens mit dem Patienten besprochen werden. Darüber hinaus ist es für ein erfolgreiches knorpelreparatives Verfahren unerlässlich, die zugrundeliegende Pathologie adäquat zu behandeln.
Die bestehende Datenlage deutet darauf hin, dass die bisherigen Erkenntnisse bezüglich knorpelchirurgischer Verfahren vom Knie zum Teil auf die Hüfte übertragen werden können. Daraus wir deutlich, dass eine hochqualitative Knorpelregeneration mit transplantierenden Verfahren auch klinisch bessere Ergebnisse im mittleren und langfristigen Verlauf zeigt.
Eine Pridie-Bohrung zeigt zwar einen höheren Einfluss von stammzellreichem Blut in den Defekt, lässt sich aber technisch in der Arthroskopie nicht realisieren. Somit zeigt sich im klinischen Alltag, dass die MFx im Rahmen der Hüft-Arthroskopie bei kleineren Defekten auch weiterhin ihre Berechtigung hat.
Bei entsprechender Defektgrösse sollten transplantierende Verfahren angestrebt werden. Hierbei stehen potenziell mit den Chondrosphären auch arthroskopisch anwendbare Verfahren zur Verfügung. Das derzeitige «Zugpferd» bei Defekten grösser als 2cm2 wird aber noch von der Autologen Matrix-Induzierten Chondrogenese (AMIC) gebildet, welche gute Ergebnisse im kurz- und mittelfristigen Verlauf zeigt.
Aktuell gibt es bereits erste Chirurgen, welche die Technik des «minced cartilage» auch arthroskopisch am Knie anwenden. Sollte sich diese Technik bezüglich klinischer Ergebnisse und Anwendbarkeit bewähren, ist eine Anwendung dieses Verfahrens auch an der Hüfte denkbar.
Referenzen
- Murphy, N.J., J.P. Eyles, and D.J. Hunter, Hip Osteoarthritis: Etiopathogenesis and Implications for Management. Adv Ther, 2016. 33(11): p. 1921-1946
- Crawford, M.J., et al., The 2007 Frank Stinchfield Award. The biomechanics of the hip labrum and the stability of the hip. Clin Orthop Relat Res, 2007. 465: p. 16-22
- Ellis, H.B., K.K. Briggs, and M.J. Philippon, Innovation in hip arthroscopy: is hip arthritis preventable in the athlete? Br J Sports Med, 2011. 45(4): p. 253-8
- Ferguson, S.J., et al., The acetabular labrum seal: a poroelastic finite element model. Clin Biomech (Bristol, Avon), 2000. 15(6): p. 463-8
- Konan, S., et al., Validation of the classification system for acetabular chondral lesions identified at arthroscopy in patients with femoroacetabular impingement. J Bone Joint Surg Br, 2011. 93(3): p. 332-6
- Nwachukwu, B.U., et al., Arthroscopic Versus Open Treatment of Femoroacetabular Impingement: A Systematic Review of Medium- to Long-Term Outcomes. Am J Sports Med, 2016. 44(4): p. 1062-8
- Crawford, K., et al., Microfracture of the hip in athletes. Clin Sports Med, 2006. 25(2): p. 327-35, x
- Lazik, A., et al., 3 Tesla high-resolution and delayed gadolinium enhanced MR imaging of cartilage (dGEMRIC) after autologous chondrocyte transplantation in the hip. J Magn Reson Imaging, 2015. 42(3): p. 624-33
- Beck, M., et al., Anterior femoroacetabular impingement: part II. Midterm results of surgical treatment. Clin Orthop Relat Res, 2004(418): p. 67-73
- Leunig, M., et al., Evaluation of the acetabular labrum by MR arthrography. J Bone Joint Surg Br, 1997. 79(2): p. 230-4
- Philippon, M.J., et al., Arthroscopic management of femoroacetabular impingement: osteoplasty technique and literature review. Am J Sports Med, 2007. 35(9): p. 1571-80
- Stubbs, A.J., E.A. Howse, and S. Mannava, Tissue engineering and the future of hip cartilage, labrum and ligamentum teres. J Hip Preserv Surg, 2016. 3(1): p. 23-9
- Albrecht, F., A. Roessner, and E. Zimmermann, Closure of osteochondral lesions using chondral fragments and fibrin adhesive. Arch Orthop Trauma Surg, 1983. 101(3): p. 213-7
- Albrecht, F.H., [Closure of joint cartilage defects using cartilage fragments and fibrin glue]. Fortschr Med, 1983. 101(37): p. 1650-2
- Levinson, C., et al., Is There a Scientific Rationale for the Refixation of Delaminated Chondral Flaps in Femoroacetabular Impingement? A Laboratory Study. Clin Orthop Relat Res, 2020. 478(4): p. 854-867
- Salzmann, G.M., A.K. Calek, and S. Preiss, Second-Generation Autologous Minced Cartilage Repair Technique. Arthrosc Tech, 2017. 6(1): p. e127-e131
- Bonasia, D.E., et al., The Degree of Chondral Fragmentation Affects Extracellular Matrix Production in Cartilage Autograft Implantation: An In Vitro Study. Arthroscopy, 2015. 31(12): p. 2335-41
- Lu, Y., et al., Minced cartilage without cell culture serves as an effective intraoperative cell source for cartilage repair. J Orthop Res, 2006. 24(6): p. 1261-70
- Lisa M. Tibor , F.D.N., and Michael Leunig, The Young Adult Hip in Sport, in The Young Adult Hip in Sport. 2014, F.S. Haddad. p. 201-212
- Volz, M., et al., A randomized controlled trial demonstrating sustained benefit of Autologous Matrix-Induced Chondrogenesis over microfracture at five years. Int Orthop, 2017. 41(4): p. 797-804
- Schiavone Panni, A., et al., Good clinical results with autologous matrix-induced chondrogenesis (Amic) technique in large knee chondral defects. Knee Surg Sports Traumatol Arthrosc, 2018. 26(4): p. 1130-1136
- Green, C.J., et al., The biology and clinical evidence of microfracture in hip preservation surgery. J Hip Preserv Surg, 2016. 3(2): p. 108-23
- Bert, J.M., Abandoning microfracture of the knee: has the time come? Arthroscopy, 2015. 31(3): p. 501-5
- Dorotka, R., et al., Repair of articular cartilage defects treated by microfracture and a three-dimensional collagen matrix. Biomaterials, 2005. 26(17): p. 3617-29
- MacDonald, A.E., et al., Indications and Outcomes for Microfracture as an Adjunct to Hip Arthroscopy for Treatment of Chondral Defects in Patients With Femoroacetabular Impingement: A Systematic Review. Arthroscopy, 2016. 32(1): p. 190-200 e2
- Philippon, M.J., et al., Can microfracture produce repair tissue in acetabular chondral defects? Arthroscopy, 2008. 24(1): p. 46-50
- Karthikeyan, S., S. Roberts, and D. Griffin, Microfracture for acetabular chondral defects in patients with femoroacetabular impingement: results at second-look arthroscopic surgery. Am J Sports Med, 2012. 40(12): p. 2725-30
- Wiewiorski, M., et al., Autologous matrix-induced chondrogenesis aided reconstruction of a large focal osteochondral lesion of the talus. Arch Orthop Trauma Surg, 2011. 131(3): p. 293-6
- Gille, J., et al., Mid-term results of Autologous Matrix-Induced Chondrogenesis for treatment of focal cartilage defects in the knee. Knee Surg Sports Traumatol Arthrosc, 2010. 18(11): p. 1456-64
- Gille, J., et al., Outcome of Autologous Matrix Induced Chondrogenesis (AMIC) in cartilage knee surgery: data of the AMIC Registry. Arch Orthop Trauma Surg, 2013. 133(1): p. 87-93
- Mancini, D. and A. Fontana, Five-year results of arthroscopic techniques for the treatment of acetabular chondral lesions in femoroacetabular impingement. Int Orthop, 2014. 38(10): p. 2057-64
- de Girolamo, L., et al., Acetabular Chondral Lesions Associated With Femoroacetabular Impingement Treated by Autologous Matrix-Induced Chondrogenesis or Microfracture: A Comparative Study at 8-Year Follow-Up. Arthroscopy, 2018. 34(11): p. 3012-3023
- Fontana, A. and L. de Girolamo, Sustained five-year benefit of autologous matrix-induced chondrogenesis for femoral acetabular impingement-induced chondral lesions compared with microfracture treatment. Bone Joint J, 2015. 97-B(5): p. 628-35
- Deng, Z., et al., Cartilage Defect Treatments: With or without Cells? Mesenchymal Stem Cells or Chondrocytes? Traditional or Matrix-Assisted? A Systematic Review and Meta-Analyses. Stem Cells Int, 2016. 2016: p. 9201492
- Pietschmann, M.F., et al., The incidence and clinical relevance of graft hypertrophy after matrix-based autologous chondrocyte implantation. Am J Sports Med, 2012. 40(1): p. 68-74
- Pietschmann, M.F., et al., Cell quality affects clinical outcome after MACI procedure for cartilage injury of the knee. Knee Surg Sports Traumatol Arthrosc, 2009. 17(11): p. 1305-11
- Niemeyer, P., et al., Autologous chondrocyte implantation (ACI) for cartilage defects of the knee: A guideline by the working group «Clinical Tissue Regeneration» of the German Society of Orthopaedics and Trauma (DGOU). Knee, 2016. 23(3): p. 426-35
- Biant, L.C., et al., The surgical management of symptomatic articular cartilage defects of the knee: Consensus statements from United Kingdom knee surgeons. Knee, 2015. 22(5): p. 446-9
- Fontana, A., et al., Arthroscopic treatment of hip chondral defects: autologous chondrocyte transplantation versus simple debridement--a pilot study. Arthroscopy, 2012. 28(3): p. 322-9
- Fickert, S., et al., Feasibility of arthroscopic 3-dimensional, purely autologous chondrocyte transplantation for chondral defects of the hip: a case series. Arch Orthop Trauma Surg, 2014. 134(7): p. 971-8
- Schroeder, J.H., et al., Injectable autologous chondrocyte transplantation for full thickness acetabular cartilage defects: early clinical results. Arch Orthop Trauma Surg, 2016. 136(10): p. 1445-51



