Neue Krankheit oder neue Erscheinungsform im Spektrum hyperinflammatorischer Syndrome?
Bereits wenige Monate nach Ausbruch der SARSCoV2 Pandemie Anfang 2020 erschienen im Frühjahr 2020 Berichte über eine ungewöhnliche Häufung von schwer verlaufenden Kawasaki Fällen resp. hyperinflammatorischem Schock in der ansonsten von schweren Verläufen der neuen Viruserkrankung wenig betroffenen pädiatrischen Altersgruppe 1, 2. Ab Mai 2020 wurden Kohorten von Patienten publiziert und kurz darauf folgte fast zeitgleich die Beschreibung eines neuen Krankheitsbildes, welches im Nordamerikanischen Raum und von der Weltgesundheitsorganisation (WHO) als Multisystem inflammatory syndrome in children associated with COVID 19 (MIS-C) und im Britisch/Europäischen Raum als Pediatric inflammatory multisysem syndrome temporarily associated with SARS-CoV2 (PIMS-TS) bezeichnet wird 3, 4.
Aus Gründen der besseren Lesbarkeit wird in diesem Artikel nur der Begriff PIMS verwendet.
Epidemiologie
Die ersten Erfahrungsberichte über den Verlauf von Covid-19 bei Kindern waren vielversprechend: Kinder waren deutlich weniger betroffen von schweren Krankheitsverläufen durch Infektionen mit SARSCoV2. Kinder erkranken weniger häufig, und auch bei nachgewiesener Infektion verläuft die Erkrankung in sehr vielen Fällen oligo- oder asymptomatisch.
Bei einem milden Krankheitsverlauf ist zu erwarten, dass die Inzidenz von stattgehabten Infektionen unterschätzt wird. In bevölkerungsbasierten Untersuchungen im Kanton Genf konnte denn auch gezeigt werden, dass Kinder ab dem Schuleintritt gleich häufig seropositiv sind für anti-SARS-CoV2 Antikörper wie der Bevölkerungsdurchschnitt. Auch bei einer ähnlichen Untersuchung an Schulkindern im Kanton Zürich korrelierte der Nachweis von anti-SARS-CoV2-Antikörpern bei den Kindern mit einer durchgemachten Erkrankung der Eltern 5, 6.
Unterdessen wurden allein in den USA > 10 000 Fälle von PIMS diagnostiziert 7, 8. Angesichts der Millionen von Covid-19 erkrankten Kinder weltweit handelt es sich bei PIMS trotz der mittlerweile vielen Tausend publizierten Fälle um eine sehr seltene, aber gefährliche Erkrankung. In bevölkerungsbasierten Studien beträgt die Inzidenz dieser Erkrankungen 2–3/100 000 Kinder 9, welche jeweils um 2–5 Wochen zeitverschoben zum Peak einer SARS-CoV-2 Infektionswelle auftreten. In altersaufgeschlüsselten Analysen zeigt sich, dass die Inzidenz bei jüngeren Kindern (0–9 Jahre) nahe bei 3/100 000 liegt und bei älteren Kindern und Jugendlichen abnimmt auf 0,4–1,5/100 000 bei den 15–20-Jährigen. Schätzungen gehen davon aus, dass ca. 0,1–0,01 % der Covid-19 infizierten Kinder ein PIMS entwickeln 10. In grossen Kohorten liegt die Mortalität von PIMS bei 0,5–2% der Fälle 7.
In den mittlerweile publizierten grossen Kohorten liegt das mittlere Alter der PIMS Patienten bei 8–9 Jahren, mit einem leichten Überwiegen des männlichen Geschlechts mit 54–62 % der Fälle 7. Der Geschlechtsunterschied ist altersabhängig, bei jüngeren Kindern gering und mit zunehmendem Alter ausgeprägter 9. PIMS betrifft Kinder, die vorgängig gesund sind, Vorerkrankungen scheinen für das Auftreten keine entscheidende Rolle zu spielen 7. In den US-amerikanischen Studien zeigen sich deutliche ethnische Unterschiede in der Prävalenz, mit einem höheren Anteil von Patienten mit afrikanischem Rheuma Schweiz Fachzeitschrift oder südamerikanischem Ursprung. Bisher ist unklar, inwieweit sich diese Beobachtung mit der höheren Anzahl Covid-19 Erkrankungen in sozioökonomisch benachteiligten Schichten erklären lässt. PIMS-Fälle werden aus vielen verschiedenen Regionen der Welt gemeldet, nur im Fernen Osten scheinen deutlich weniger Fälle aufzutreten. So konnte in Tokyo seit Beginn der Pandemie weder eine Änderung der Inzidenz noch der Schwere von Fällen mit Kawasaki Syndrom gefunden werden 11.
Verglichen mit den ersten beiden Infektionswellen 2020 nahm die relative Häufigkeit von PIMS während den späteren Infektionswellen mit verschiedenen Virusvarianten (Delta, Omikron) ab 10. Zudem liess sich nach der Zulassung der Impfung auch für die Altersgruppe 5–15 Jahre sowohl in Frankreich, Dänemark als auch in den USA eine deutliche Abnahme der PIMS-Inzidenz bei geimpften versus ungeimpften Kindern zeigen 8, 12, 13.
Klinik
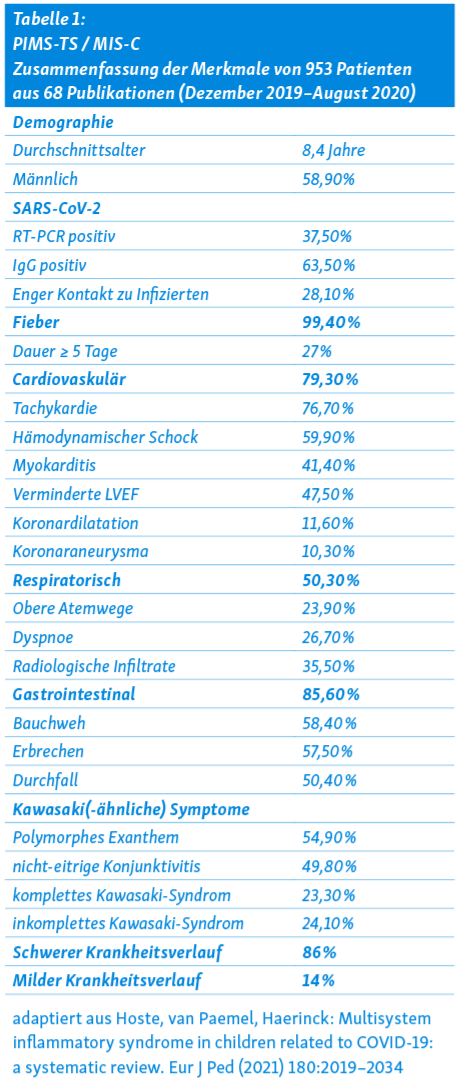
Das mittlere Alter der betroffenen Kinder liegt bei 8–9 Jahren und ist damit deutlich höher als beim Kawasaki Syndrom. Alle betroffenen Kinder zeigen Zeichen einer heftigen systemischen Entzündung mit anhaltendem Fieber, reduziertem AZ, stark erhöhten Entzündungszeichen im Labor (CRP, Fibrinogen, Ferritin) und Involvierung verschiedener Organsysteme. Neben dem Fieber sind gastro-intestinale, cardiovaskuläre, mucocutane und neurologische Symptome am häufigsten. In der überwiegenden Mehrheit der Fälle kann eine aktuelle oder kürzlich (bis zu 4 Wochen vorher) durchgemachte Infektion mit SARS-CoV2 nachgewiesen werden 14, 15.
Mithilfe einer latent class Analyse liess sich eine grosse Kohorte von fast 1000 PIMS Patienten in 3 unterschiedliche Patientencluster aufteilen: eine Gruppe mit früh und rasch auftretendem hypotensivem Schock aufgrund myocardialer Dysfunktion, eine Gruppe mit Kawasaki-ähnlichen mucocutanen Symptomen (welche häufig auch die Kriterien für ein Kawasaki-Syndrom erfüllt) und eine dritte Gruppe mit unspezifischen Entzündungszeichen ohne myocardiale oder mucocutane Beteiligung 16. In grossen Patientenkohorten zeichnet sich ab, dass die mucocutanen Symptome bei jüngeren Kindern häufiger sind, bei den älteren stehen gastro-intestinale Symptome (Bauchschmerzen, Erbrechen, Diarrhoe) und cardiale Dysfunktion oft im Vordergrund der klinischen Präsentation (Tabelle 1).
Diagnose-Kriterien
Es wurden verschiedene, in den Details leicht unterschiedliche Diagnosekriterien definiert von der WHO (https://www.who.int/news-room/commentaries/detail/multisystem-inflammatory-syndrome-in-children-and-adolescents-with-covid-19), dem US-amerikanischen Center of Disease Control (CDC) (https://emergency.cdc.gov/han/2020/han00432.asp), dem britischen Royal College of Paediatrics and Child Health (RCPCH) (https://www.rcpch.ac.uk/sites/default/files/2020-05/COVID-19-Paediatric-multisystem-%20inflammatory%20syndrome-20200501.pdf). In der Schweiz hat sich eine interdisziplinäre Arbeitsgruppe gebildet, welche im Frühling 2021 Empfehlungen für die Diagnose und Therapie vom PIMS und in der Folge auch eine multizentrische randomisierte Studie zu verschiedenen Therapieoptionen begonnen hat 17. Die von dieser Arbeitsgruppe publizierten Diagnosekriterien finden Sie in Tabelle 2.
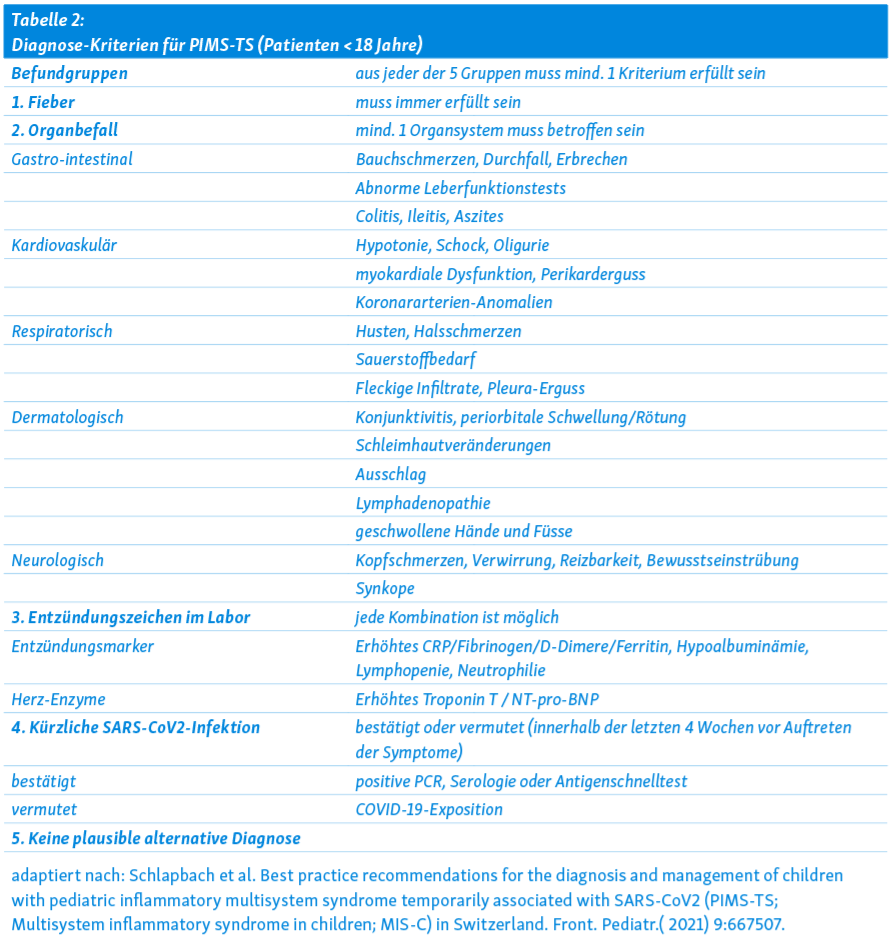
Alle Diagnosekriterien wurden initial mit der Absicht erstellt, die Erfassung und Meldung dieses neuen Krankheitsbildes zu erleichtern. Der Fokus lag dabei auf den schweren, lebensbedrohlichen Verläufen. In der Zwischenzeit zeigt sich, dass es sich wahrscheinlich um ein Krankheitsbild mit einem sehr breiten Spektrum von unterschiedlichen Manifestationen und Schweregraden handelt 18, 19.
Die Diagnosestellung und die Differenzialdiagnose sind häufig anspruchsvoll, da eine Covid 19 Infektion bei Kindern oft oligo- oder asymptomatisch verläuft und die entsprechende Anamnese fehlt. Andererseits können selten auch Kinder mit einer akuten Covid-19 Infektion erheblich krank sein, und die Differenzialdiagnose zwischen akuter Covid-19 Infektion und PIMS ist unter Umständen nicht einfach. Aufgrund der klinischen Präsentation muss in erster Linie eine bakterielle Infektion und Sepsis, ein Toxic shock syndrome, eine andere virale Infektion oder auch ein akutes Abdomen (z. B. Appendizitis) ausgeschlossen werden. Da der Verlauf insbesondere bei cardialem Befall fulminant sein kann und in einem sehr hohen Prozentsatz (60–80 %) der publizierten Fälle eine intensivmedizinische Behandlung nötig war, muss die differenzialdiagnostische Abklärung zwar unbestritten sorgfältig erfolgen, sollte aber den Beginn der immunmodulatorischen Behandlung nicht unnötig verzögern 17.
Verschiedene Krankheits-/Verlaufsformen
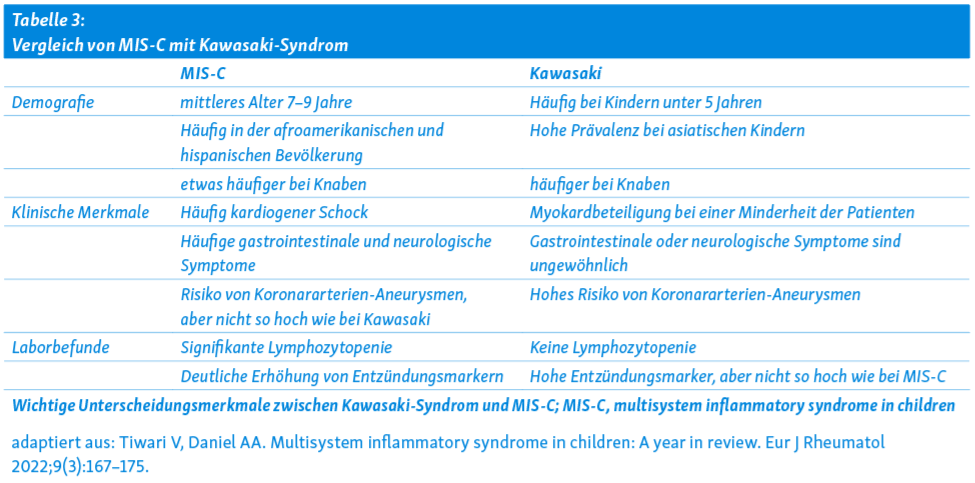
In den ersten Fallbeschreibungen und -Serien war einerseits von einer starken Häufung von Fällen mit schwer verlaufendem Kawasaki Syndrom die Rede, andererseits die schweren cardialen Dysfunktionen im Zusammenhang mit dem Bild eines Zytokinsturms mit Multiorganbeteiligung. In der Zwischenzeit liegen zusätzliche Erkenntnisse aus sehr grossen Kohorten vor, und das Bild wird differenzierter, aber auch komplexer. Neben den häufigen Symptomen wie Fieber, gastrointenstinale und mucocutane Symptome und cardiovaskuläre Dysfunktion wurde unterdessen eine Vielzahl zusätzlicher Organmanifestationen beschrieben 14, 20. Die Symptome von PIMS sind insgesamt wenig spezifisch, jedes Organsystem kann betroffen sein, mit unterschiedlichem Schweregrad und zeitlichem Ablauf. Für eine Übersicht über die häufigsten Symptome und Befunde, siehe Tabelle 3.
Ein hoher Prozentsatz (60–80 %) von betroffenen Kindern wird intensivpflichtig, viele brauchen inotrope Substanzen zur Stützung des Kreislaufs, invasive Beatmung, ca. 1–2 % auch ECMO (extra corporeal membrane oxygenation). Es versteht sich, dass im Zuge solcher intensiven Behandlungen nicht nur Krankheits- sondern auch Behandlungskomplikationen auftreten und sich das eine nicht immer zweifelsfrei vom anderen unterscheiden lässt. Es besteht ein erhöhtes Thromboserisiko im Rahmen des Zytokinsturms, möglicherweise aber auch begünstigt durch eine direkte Endothelschädigung durch das Virus, wie aus Erwachsenen-Kohorten gut bekannt ist.
Die oben erwähnte Schweizer Arbeitsgruppe 17 hat zur Stratifizierung im Hinblick auf das therapeutische Vorgehen die Erscheinungsformen in 3 grosse Cluster aufgeteilt:
Schock-ähnliche Form
Patienten qualifizieren für diese Gruppe, wenn sie die Goldstein-Kriterien für kardiovaskulären Schock im Kindesalter erfüllen 21. Diese Verlaufsform ist häufiger in der Gruppe der etwas älteren Kinder und Knaben sind häufiger betroffen 3, 16. Wie schon die Bezeichnung sagt, steht klinisch im Vordergrund eine oft ausgeprägte und fulminant auftretende myocardiale Dysfunktion, welche differenzialdiagnostisch an einen septischen oder Toxin-Schock erinnert. Kinder mit dieser Verlaufsform sind in der Regel intensivpflichtig, brauchen inotrope Substanzen und Beatmung bis hin zu ECMO. Ähnlich wie bei der Erkrankung im Erwachsenenalter beschrieben, finden sich auch bei diesen schwerkranken Kindern und Jugendlichen gehäuft thrombotische Ereignisse, begünstigt durch Endothelveränderungen und Kreislaufsituation 3. Nach der oft sehr schweren initialen Dysfunktion zeigt das Myocard eine gute Erholungsfähigkeit, in der Regel mit vollständiger Wiederherstellung der Funktion 22.
Kawasaki-ähnliche Form
Die Patienten dieser Gruppe erfüllen die Kriterien der American Heart Association (AHA) für komplettes oder inkomplettes Kawasaki-Syndrom 23. In grossen PIMS-Patientenkohorten zeigt sich, dass vor allem jüngere Kinder zur Verlaufsform mit Kawaski-ähnlichen Symptomen neigen 16.
Undifferenzierte Form
Der dritte Cluster von Patienten hat ebenfalls ein inflammatorisches Krankheitsbild mit anhaltendem Fieber und Beteiligung mehrerer Organsysteme ohne Nachweis einer anderen Erklärung für das Geschehen, erfüllt aber weder die Definition für Schock noch die Definition für Kawasaki-Syndrom. Die Erkrankung dieser Patienten ist in der Regel mild.
Pathogenese
Da PIMS insgesamt sehr selten auftritt, ist es wahrscheinlich, dass – ähnlich wie bei Kawasaki Syndrom – eine genetische Prädisposition besteht, welche beim Zusammentreffen mit einem infektiösen Trigger zu einer hyperinflammatorischen Immunantwort führt. Tatsächlich konnte mit whole-exome sequencing bei einer kleinen Gruppe von PIMS Patienten bereits eine genetische Prädisposition für eine pro-inflammatorische Immunantwort auf Infektionen nachgewiesen werden 24, 25. In diesem Zusammenhang interessant ist auch die Beobachtung, dass PIMS zwar weltweit auftritt, aus Ostasien allerdings deutlich seltener berichtet wird als aufgrund der dortigen Fallzahlen zu erwarten wäre. Wie bereits weiter oben erwähnt konnte in Japan – dem Land der Erstbeschreibung des Kawasaki Syndroms – keine Änderung der Inzidenz von Kawasaki Syndrom während der Covid-19 Pandemie festgestellt werden 11. Solche geographischen Unterschiede könnten ein Hinweis auf unterschiedliche genetische Prädisposition sein.
Es besteht eine Vielzahl von Hypothesen zur möglichen Pathogenese von PIMS. Eine geht – ähnlich wie bei Kawasaki Syndrom – von einem möglichen Superantigen-Effekt aus 26. Dadurch kommt es zu einer exzessiven T-Zell-Aktivierung mit Freisetzung von grossen Mengen an pro-inflammatorischen Zytokinen wie TNF alpha, Interleukin-6 und Interferon gamma. Diese Hypothese wird gestützt durch Studien zur Diversität des T-Zell-Rezeptor-Repertoires von Kindern mit PIMS, welche zeigten, dass dieses unverändert erhalten war, was gegen eine T-Zell-Aktivierung via Antigen-MHC-Komplex spricht 27.
Andere Hypothesen gehen von einer anhaltenden Virus-Replikation und/oder einer insuffizienten Immunantwort aus. Gestützt wird diese Hypothese durch Besonderheiten im Zytokinprofil von PIMS Patienten im Vergleich zu Kawasaki-Syndrom oder Toxic Schock Syndrom 28, 29. In post mortem Studien bei Kawasaki Patienten wurde eine nekrotisierende Arteriitis mit neutrophiler Infiltration der Tunica media und der glatten Gefässwand-Muskulatur beschrieben. Ähnliche nekrotisierende Endothelveränderungen sind typisch für Patienten mit PIMS. Bei Kindern mit PIMS wurden zudem auch Autoantikörper gegen verschiedene endotheliale und cardiale Proteine und im Gastrointestinaltrakt vorkommende Proteine nachgewiesen. Noch unklar ist, ob es sich dabei um auslösende Faktoren im Entzündungsverlauf handelt, oder um Antikörper, welche sekundär in Folge der Zellnekrose gebildet wurden 30.
Ähnlichkeiten und Unterschiede zwischen PIMS, Kawasaki Syndrom und Makrophagen Aktivierungs-Syndrom (MAS)
Ähnlich dem an lokale Covid-19 Infektionswellen anschliessenden Auftreten von gehäuften Fällen von PIMS lässt sich auch ein entsprechender Anstieg von Fällen mit Kawasaki Syndrom zeigen. Die Überlappung der beiden Krankheitsbilder wird dadurch zusätzlich verdeutlicht, dass jeweils ein Teil der Patienten die Kriterien für beide Krankheitsbilder erfüllt 19, 31, 32.
Bereits mit den ersten Fallbeschreibungen hat eine intensive und bisher ungelöste Debatte darüber begonnen, ob PIMS ein eigenständiges Krankheitsbild ist oder vielmehr ein Teil eines Krankheitsspektrums, zu dem auch andere Syndrome mit hyperinflammatorischem Zytokinsturm gehören, wie Kawasaki-Syndrom, Toxic Shock Syndrome, Makrophagenaktivierungs-Syndrom. Für beide Thesen – eigenes, neues Krankheitsbild und Teil eines Krankheits-Spektrums – gibt es Argumente und Gegenargumente. Die wichtigsten seien hier genannt:
- Im Vergleich zum Kawasaki Syndrom stehen beim PIMS klinisch gastro-intestinale und neurologische Symptome auffällig häufig im Vordergrund, und die Kinder sind älter. Sogar bei Erwachsenen wurden Fälle beschrieben.
- Eine kardiale Beteiligung besteht bei über 50% der Patienten und damit deutlich häufiger als beim Kawasaki-Syndrom. Damit verbunden ist auch eine intensivmedizinische Behandlung sehr viel häufiger nötig.
- PIMS scheint bei Kindern afrikanischer und lateinamerikanischer Herkunft deutlich häufiger zu sein, aber bei ostasiatischen Kindern selten. Im Gegensatz dazu ist das Kawasaki Syndrom bei Kindern ostasiatischer Herkunft besonders häufig.
- PIMS und Kawasaki-Patienten haben ähnliche Zytokin-Profile, aber bei PIMS ist CXCL9 sehr viel stärker erhöht.
- Bei allen Präsentationsformen von PIMS können innerhalb der ersten 3 Wochen der Erkrankung Coronar-Aneurysmen auftreten, insgesamt in etwa 18% der Fälle. Das ist erheblich tiefer als bei unbehandeltem Kawasaki Syndrom (28%).
- Auch bei PIMS-Kindern, welche die Kawasaki-Kriterien erfüllen, sind die Organmanifestationen anders als bei klassischem Kawasaki-Syndrom beschrieben.
- Allerdings gibt es auch beim klassischen Kawasaki-Syndrom eine als Kawasaki-shock beschriebene Verlaufsform, die etwa in 5% der Fälle auftritt. Die Patienten mit dieser Form sind älter und häufiger Knaben. Ähnlich wie bei PIMS sind die mucocutanen Symptome in dieser Gruppe weniger ausgeprägt und gastrointestinale Symptome sind häufig. Auch bei den Kawasaki-shock Patienten wird in der Regel eine rasche und vollständige Erholung der myocardialen Funktion beobachtet.
- Zudem erfüllt eine relativ grosse Gruppe von PIMS Patienten gleichzeitig auch die Kriterien des klassischen kompletten oder inkompletten Kawasaki Syndroms gemäss AHA.
- In Bevölkerungsstudien lassen sich Wellen von PIMS zeigen, welche jeweils 2–5 Wochen nach einer Covid-19-Infektionswelle auftreten. Die gleichen Wellen mit dem gleichen Abstand treten auch für Kawasaki-Fälle auf.
- Das Auftreten von zwei Krankheitsbildern in der gleichen Population und in der gleichen Zeit – in der zudem aufgrund der Lockdown-Massnahmen zumindest bei den italienischen Kindern kaum eine Exposition zu anderen Infektionen bestand – ist ein starkes Argument für die These, dass es sich um ein Kontinuum von verschiedenen Ausprägungsgraden desselben Krankheitsbildes handelt. Das Alter scheint bei der Art der Manifestation eine wichtige Rolle zu spielen.
Behandlung und Outcome
Die Behandlung besteht einerseits aus den supportiven Massnahmen, die zur Erhaltung der lebenswichtigen Funktionen nötig sind. Dabei muss ein grosser Teil der Patienten auf einer Intensivstation betreut werden (60–80%), brauchen inotrope Substanzen (30–45%), invasive Beatmung (15–25%), auch ECMO (bis zu 5 %). Die Mortalität liegt bei 0,3–2% 18. Auf der anderen Seite des weiten Spektrums stehen Patienten ohne cardiale oder mucocutane Symptome und teilweise sogar mit spontaner Heilung 18.
Das Ansprechen auf eine immunmodulatorische Therapie ist in der Regel rasch und gut, sie besteht wie bei der Behandlung des Kawasaki-Syndroms aus hochdosierten intravenösen Immunglobulinen (IVIG) (2 g/kg Körpergewicht) und Corticosteroiden. Die Kombination dieser beiden führt insbesondere bei den schweren PIMS-Formen zu einem deutlich besseren Ansprechen und rascherer Erholung 33. Erste kleinere Studien zeigen, dass auch eine Behandlung mit Corticosteroiden allein, d. h. ohne IVIG, zu einer raschen Entzündungshemmung und Erholung der linksventrikulären Funktion führt. In Fällen mit therapierefraktärem Verlauf werden verschiedene Biologika eingesetzt, insbesondere Interleukin-1 (Anakinra), Interleukin-6 (Tocilizumab) und TNF alpha (Infliximab)-Blocker 17.
In milderen Fällen hingegen kann auch IVIG alleine genügen, und es werden auch Fälle mit spontaner Regredienz der Entzündung beschrieben. Sowohl bei Schock als auch bei Kawasaki-ähnlicher Präsentation wird zudem eine antithrombotische Therapie entweder mit niedermolekularem Heparin oder mit Aspirin empfohlen.
Insgesamt ist die Prognose für die überwiegende Mehrheit der Fälle sehr gut – trotz dem initial oft dramatischen Krankheitsverlauf 22. Die cardiale Funktion erholt sich in der Regel in wenigen Wochen vollständig, unabhängig vom Schweregrad bei Krankheitsbeginn, und es kann von einer Restitutio ad integrum ausgegangen werden. Unabhängig von der guten Erholung der Organfunktionen wurden aber auch Fälle von länger dauernder Rekonvaleszenz und Erschöpfungszuständen analog zu den als Post-Covid-Syndrom beschriebenen Zuständen beschrieben.
Zusammengefassung
Es handelt sich bei PIMS-TS um ein seltenes, schweres Krankheitsbild, das im Zusammenhang mit der SARS-CoV2 Pandemie erstmals beschrieben wurde. Es betrifft vor allem Kinder und Jugendliche, kann aber auch bei Neugeborenen und bei Erwachsenen auftreten. Die Krankheit zeigt Aspekte, welche mit bekannten hyperinflammatorischen Krankheitsbildern überlappen, insbesondere Kawasaki Syndrom, Toxic-shock-Syndrom und Makrophagenaktivierungs-Syndrom. Das Spektrum und der Schweregrad der Erkrankung ist individuell äusserst variabel, aber ein sehr hoher Anteil von Patienten ist kritisch krank. Bei zeitgerechter adäquater Therapie ist die Prognose gut.
Referenzen
- Verdoni, L., et al., An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet, 2020. 395(10239): p. 1771–1778.
- Riphagen, S., Understanding Covid and the associated post-infectious hyper-inflammatory state (PIMS-TS) in children. Med Hypotheses, 2020. 144: p. 110029
- Feldstein, L.R., et al., Multisystem Inflammatory Syndrome in U.S. Children and Adolescents. N Engl J Med, 2020. 383(4): p. 334–346.
- Dufort, E.M., et al., Multisystem Inflammatory Syndrome in Children in New York State. N Engl J Med, 2020. 383(4): p. 347–358.
- Stringhini, S., et al., Seroprevalence of anti-SARS-CoV-2 antibodies after the second pandemic peak. Lancet Infect Dis, 2021. 21(5): p. 600–601.
- Ulyte, A., et al., SARS-CoV-2 seroprevalence in children, parents and school personnel from June 2020 to April 2021: cohort study of 55 schools in Switzerland. Swiss Med Wkly, 2022. 152: p. w30193.
- Miller, A.D., et al., Multisystem Inflammatory Syndrome in Children-United States, February 2020-July 2021. Clin Infect Dis, 2022. 75(1): p. e1165-e1175.
- Miller, A.D., et al., Multisystem Inflammatory Syndrome in Children During Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Delta and Omicron Variant Circulation-United States, July 2021-January 2022. Clin Infect Dis, 2022. 75(Supplement_2): p. S303–s307.
- Belay, E.D., et al., Trends in Geographic and Temporal Distribution of US Children With Multisystem Inflammatory Syndrome During the COVID-19 Pandemic. JAMA Pediatr, 2021. 175(8): p. 837–845.
- Sorg, A.L., et al., SARS-CoV-2 variants and the risk of pediatric inflammatory multisystem syndrome temporally associated with SARS-CoV-2 among children in Germany. Infection, 2022: p. 1–7.
- Iio, K., et al., Kawasaki disease or Kawasaki-like disease: Influence of SARS-CoV-2 infections in Japan. Acta Paediatr, 2021. 110(2): p. 600–601.
- Levy, M., et al., Multisystem Inflammatory Syndrome in Children by COVID-19 Vaccination Status of Adolescents in France. Jama, 2022. 327(3): p. 281–283.
- Nygaard, U., et al., Incidence and clinical phenotype of multisystem inflammatory syndrome in children after infection with the SARS-CoV-2 delta variant by vaccination status: a Danish nationwide prospective cohort study. Lancet Child Adolesc Health, 2022. 6(7): p. 459–465.
- Hoste, L., R. Van Paemel, and F. Haerynck, Multisystem inflammatory syndrome in children related to COVID-19: a systematic review. Eur J Pediatr, 2021. 180(7): p. 2019–2034.
- Roberts, J.E. and L.A. Henderson, Clinical features of multisystem inflammatory syndrome in children. Curr Opin Rheumatol, 2021. 33(5): p. 378–386.
- Godfred-Cato, S., et al., COVID-19-Associated Multisystem Inflammatory Syndrome in Children - United States, March-July 2020. MMWR Morb Mortal Wkly Rep, 2020. 69(32): p. 1074–1080.
- Schlapbach, L.J., et al., Best Practice Recommendations for the Diagnosis and Management of Children With Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2 (PIMS-TS; Multisystem Inflammatory Syndrome in Children, MIS-C) in Switzerland. Front Pediatr, 2021. 9: p. 667507.
- Whittaker, E., et al., Clinical Characteristics of 58 Children With a Pediatric Inflammatory Multisystem Syndrome Temporally Associated With SARS-CoV-2. Jama, 2020. 324(3): p. 259–269.
- Lee, P.Y., et al., Distinct clinical and immunological features of SARS-CoV-2-induced multisystem inflammatory syndrome in children. J Clin Invest, 2020. 130(11): p. 5942–5950.
- Waseem, M., et al., Multisystem Inflammatory Syndrome in Children. West J Emerg Med, 2022. 23(4): p. 505–513.
- Goldstein, B., B. Giroir, and A. Randolph, International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med, 2005. 6(1): p. 2–8.
- Davies, P., et al., One-Year Outcomes of Critical Care Patients Post-COVID-19 Multisystem Inflammatory Syndrome in Children. JAMA Pediatr, 2021. 175(12): p. 1281–1283.
- McCrindle, B.W., et al., Diagnosis, Treatment, and Long-Term Management of Kawasaki Disease: A Scientific Statement for Health Professionals From the American Heart Association. Circulation, 2017. 135(17): p. e927–e999.
- Chen, M.R., et al., Phenotype, Susceptibility, Autoimmunity, and Immunotherapy Between Kawasaki Disease and Coronavirus Disease-19 Associated Multisystem Inflammatory Syndrome in Children. Front Immunol, 2021. 12: p. 632890.
- Chou, J., et al., Mechanisms underlying genetic susceptibility to multisystem inflammatory syndrome in children (MIS-C). J Allergy Clin Immunol, 2021. 148(3): p. 732–738.e1.
- Roarty, C. and T. Waterfield, Review and future directions for PIMS-TS (MIS-C). Arch Dis Child, 2022.
- Porritt, R.A., et al., HLA class I-associated expansion of TRBV11-2 T cells in multisystem inflammatory syndrome in children. J Clin Invest, 2021. 131(10).
- Porritt, R.A., et al., The autoimmune signature of hyperinflammatory multisystem inflammatory syndrome in children. J Clin Invest, 2021. 131(20).
- Consiglio, C.R., et al., The Immunology of Multisystem Inflammatory Syndrome in Children with COVID-19. Cell, 2020. 183(4): p. 968–981.e7.
- Ramaswamy, A., et al., Immune dysregulation and autoreactivity correlate with disease severity in SARS-CoV-2-associated multisystem inflammatory syndrome in children. Immunity, 2021. 54(5): p. 1083–1095.e7.
- Yeung, R.S. and P.J. Ferguson, Is multisystem inflammatory syndrome in children on the Kawasaki syndrome spectrum? J Clin Invest, 2020. 130(11): p. 5681–5684.
- Diorio, C., et al., Multisystem inflammatory syndrome in children and COVID-19 are distinct presentations of SARS-CoV-2. J Clin Invest, 2020. 130(11): p. 5967–5975.
- Son, M.B.F., et al., Multisystem Inflammatory Syndrome in Children – Initial Therapy and Outcomes. N Engl J Med, 2021. 385(1): p. 23–34.
