Morbus Perthes
Der Morbus Perthes ist eine kindliche Erkrankung des Hüftkopfes, welche typischerweise im Alter zwischen vier und zehn Jahren auftritt, in ca. 10 % der Fälle beidseits. Jungen sind gehäuft betroffen (5:1). Es kommt beim M. Perthes zu einer aseptischen Nekrose (Durchblutungsstörung mit teilweisem Kollaps) des Hüftkopfes. Die Ursache bleibt meist unklar. Es werden genetische Störungen im Blutgerinnungssystem, Gefässanomalien, Traumata und Umweltfaktoren wie z. B. Passivrauchen diskutiert.
Symptome und Diagnosestellung
Die frühe Diagnose kann mitunter schwierig sein, da es erst später im Verlauf zu typischen radiologischen Auffälligkeiten kommt. Eine frühere Diagnose wie auch die Abgrenzung zu anderen Erkrankungen kann mittels MRI erreicht werden.
Die ersten Symptome sind unspezifisch. Meist kommt es zu episodenhaftem Hinken mit Hüft-, Oberschenkel- oder Knieschmerzen. Typisch ist eine schmerzhaft eingeschränkte Innenrotationsfähigkeit des Hüftgelenkes.
Da diese Symptome am Anfang der Krankheit auch bei harmlosen Problemen wie «Hüftschnupfen»(Coxitis fugax), Verletzungen, aber auch gravierenden Problemen wie einer Hüftgelenksinfektion auftreten können, erfordert die Abklärung ein sorgfältiges Vorgehen ggf. inkl. Ultraschall, Röntgen, Laboruntersuchung und MRI.
Nach der Diagnose: Wie geht es nun weiter?
Nach Diagnosestellung erfolgt die umfassende Beratung der Familie über den Krankheitsverlauf und die notwendigen Massnahmen auch unter Einbeziehung des Umfelds wie z. B. Schule oder Kindergarten und den betreuenden Physiotherapeuten. Eine Anpassung der Belastung sowie eine gute bedarfsabhängige Schmerztherapie sollten gewährleistet sein.
Der Schweregrad der Erkrankung und damit auch das langfristige Ergebnis sind individuell sehr unterschiedlich. Grundsätzlich kann gesagt werden, dass die Erkrankung meist umso gutartiger verläuft, je jünger das betroffene Kind bei Erkrankungsbeginn ist.
Da der Verlauf sehr individuell ist und je nach Situation unterschiedliche Massnahmen erfordert, ist es wichtig, die Patienten regelmässig klinisch wie auch radiologisch zu kontrollieren. Typischerweise werden am Anfang zunächst Kontrollen alle sechs Wochen, später dann in längeren Intervallen durchgeführt.
Krankheitsverlauf, konservative und operative Therapie
Der Verlauf der Pertheserkrankung folgt typischen Krankheitsstadien und dauert in der Regel zwischen zwei und fünf Jahren (Abb. 1 bis 4).
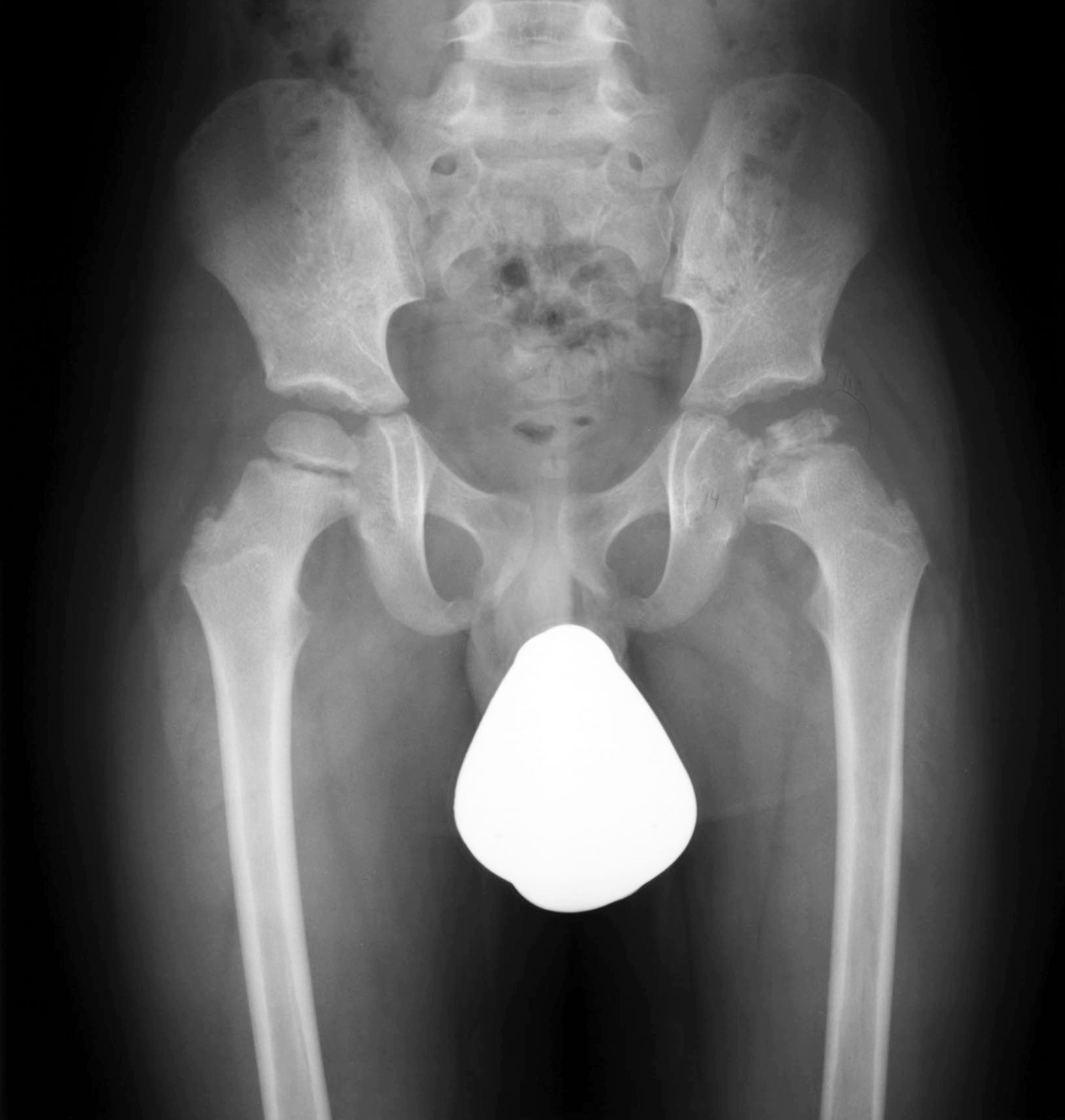
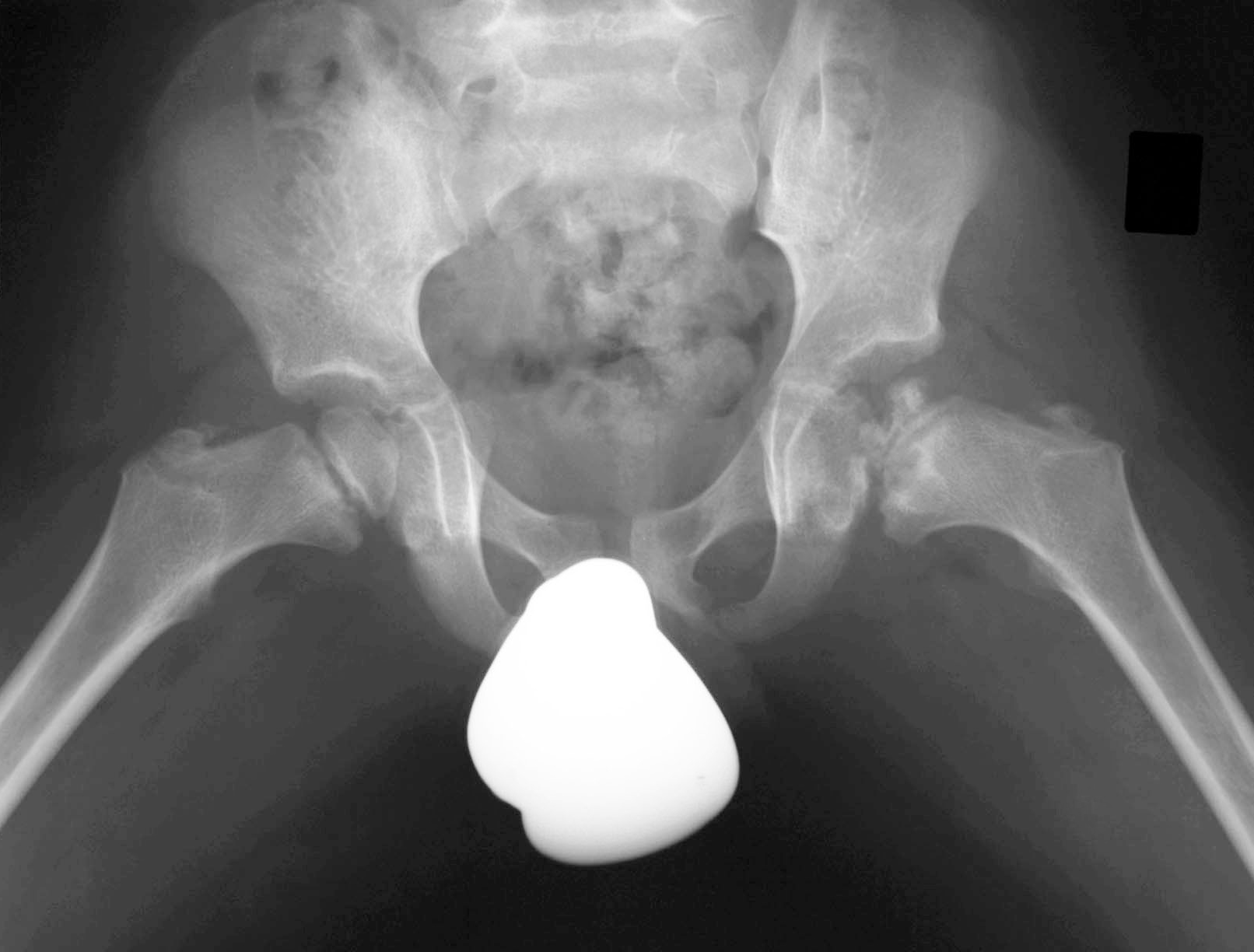




Initial kommt es zu einer Verdichtung und Abflachung des Hüftkopfes zunächst im oberen, gelenksnahen Bereich Kinder- und Jugendorthopädie, Schulthess Klinik, Zürich. Mit weiterem Fortschreiten der Erkrankung fragmentiert sich dann der Knochen des Hüftkopfes und kann so seine sphärische, zur Gelenkspfanne passende Form verlieren, indem er immer flacher und breiter wird, in schweren Fällen bis hin zum Kollaps des Kopfes. Je breiter der Hüftkopf wird und je schlechter seine Form dadurch zur Gelenkspfanne passt, umso mehr ist die Beweglichkeit des Hüftgelenkes eingeschränkt und umso mehr kommt es zu Hinken und Schmerzen.
Diese Formveränderungen des Hüftkopfes werden regelmässig mittels Röntgen kontrolliert. Hierbei ist es wichtig, eine drohende Dekompensation des Hüftgelenks rechtzeitig zu diagnostizieren und entsprechende Gegenmassnahmen zu treffen.
Starke Belastungen, v. a. Stossbelastungen sind zu vermeiden. Dies beinhaltet Sportkarenz, Anpassung des Verhaltens im Alltag sowie manchmal auch Entlastung an Gehstützen.
Begleitende Physiotherapie ist wichtig, um einer schleichenden Verschlechterung der Beweglichkeit, vor allem der Innenrotation und der Abspreizfähigkeit des Hüftgelenkes, entgegenzuwirken.
Im Idealfall kann so eine höhergradige Deformierung des Hüftkopfes verhindert werden, und es kommt im Verlauf zum Wiederaufbau des Hüftkopfes in passender Form, sodass auch langfristig mit einer guten Funktion gerechnet werden kann.
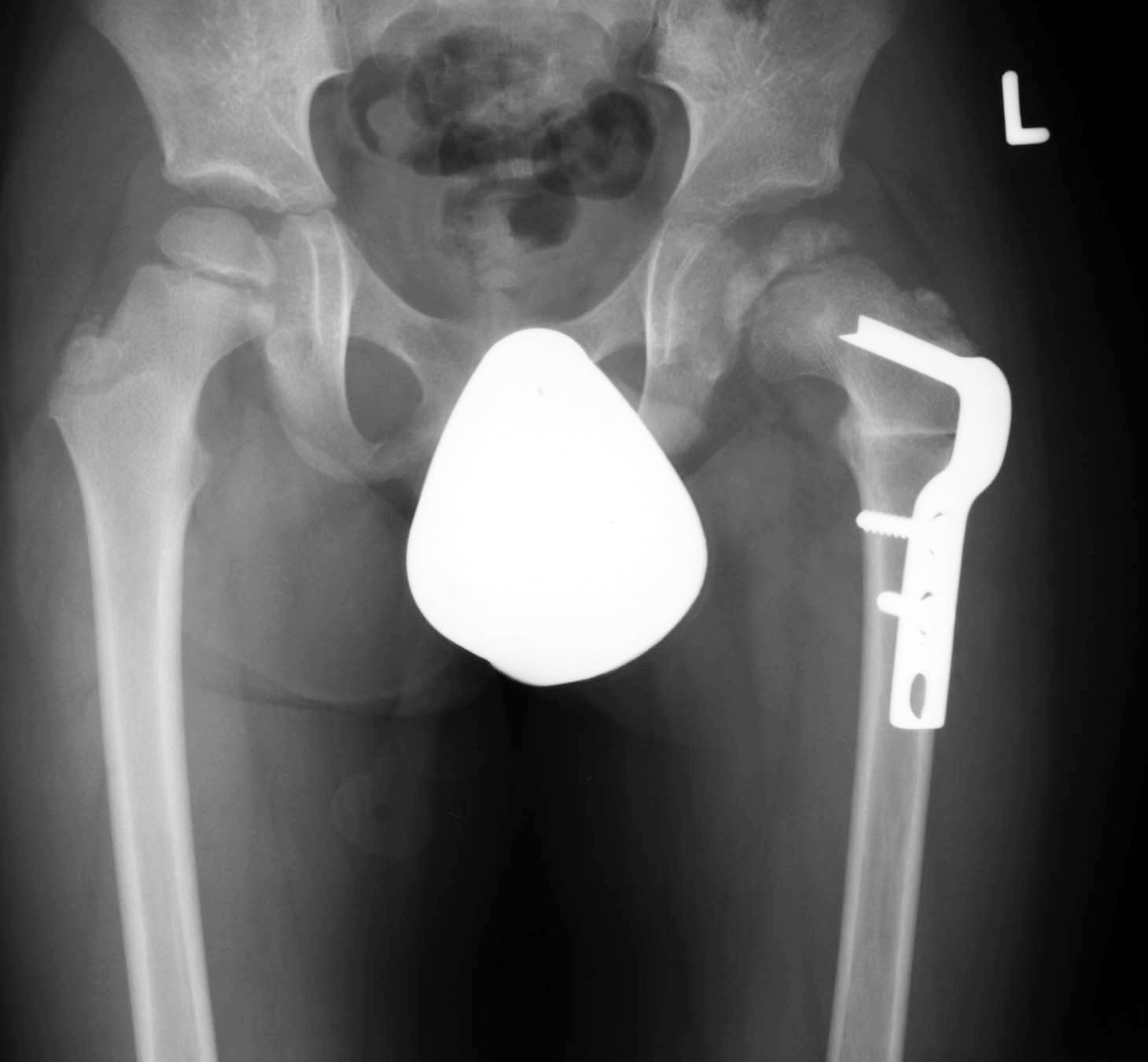
In manchen Fällen ist es jedoch notwendig, mittels operativer Massnahmen die Form und Funktion des Hüftgelenks zu erhalten. Dies nennt man «Containmenterhalt » (Abb. 5 und 6).

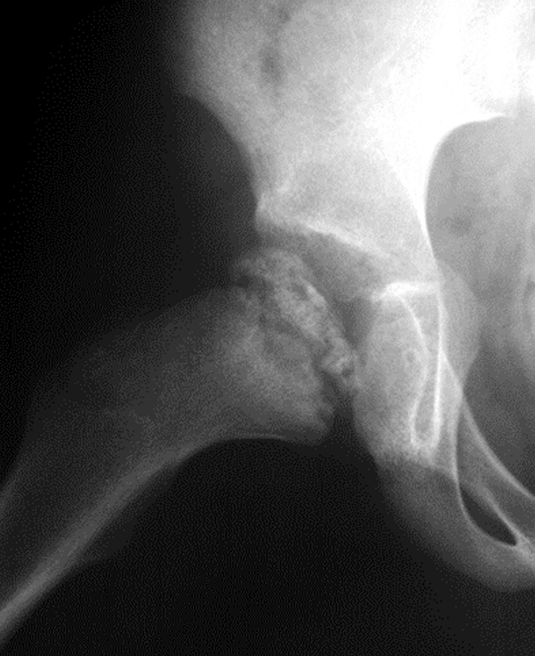


Die notwendigen operativen Massnahmen richten sich nach dem jeweiligen Befund. Häufig kommt es durch die übermassige Verbreiterung des Hüftkopfes zu einem sogenannten «Hinge-abduction-Phänomen». Der aus der Hüftpfanne seitlich herausragende Hüftkopf «klemmt» beim Abspreizen der Hüfte am Pfannenerker und verursacht dort Knorpel- und Knochenschäden. Diese Situation wird zunächst durch spezielle Röntgenaufnahmen (Abduktionsaufnahme) und ggf. dann durch eine Untersuchung in Narkose mittels Arthrographie beurteilt. Es kann dann im Rahmen derselben Narkose auch eine operative Korrektur der knöchernen Fehlstellung durchgeführt werden. Hierbei wird meist im Rahmen einer Beckenosteotomie
die Gelenkpfanne weiter über den Hüftkopf geschwenkt, um den Formschluss wieder herzustellen, oder auch eine Formkorrektur im Bereich des gelenknahen Teils des Oberschenkelknochens zur Reduktion des Impingements vorgenommen. Auch wenn die Perthes-Erkrankung sich leider nicht im eigentlichen Sinne heilen oder aufhalten lässt, kann doch der Krankheitsverlauf durch individuell angepasste Therapie meist günstig beeinflusst werden.
Langfristige Massnahmen
Nach Ablauf der Pertheserkrankung werden die längerfristigen Massnahmen besprochen. Diese reichen von der Sport- und Berufsplanung, Massgaben für den Alltag bis hin zur operativen Korrektur von verbliebenen Restdeformitäten. Besonders zu erwähnen ist hier die Möglichkeit der Korrektur von Taillierungsstörungen des Kopf-Schenkelhalsübergangs mittels Hüftarthroskopie, der Korrektur von Hüftmuskelinsuffizienz durch eine relative Schenkelhalsverlängerung bis hin zur Hüftkopfverkleinerung und Therapie von entstandenen Knorpelschäden.
Hüftkopfepiphysenlösung (Epiphyseolysis capitis femoris)
Einleitung
Bei der Epiphyseolysis capitis femoris handelt es sich um eine Epiphysenlösung des Hüftkopfes, wobei der Hüftkopf gegenüber dem Schenkelhals entlang der Wachstumsfuge nach dorsal abrutscht. Ein wichtiger Faktor ist die im pubertären Wachstumsschub auftretende Lockerung der mechanisch stark belastenden Hüftkopfepiphysenfuge. Es wird ein Zusammenhang mit einer abnormalen Stellung der Wachstumsfuge zu den mechanischen Kräften, aber auch hormonelle
Einflüsse diskutiert. Da diese Erkrankung gehäuft bei adipösen Jugendlichen auftritt, wird auch erörtert, ob möglicherweise abnorm hohe Scherkräfte auf die Wachstumsfuge wirken. In seltenen Fällen liegt ein begleitendes oder auslösendes Trauma vor. Die Häufigkeit liegt bei etwa 0,2 bis 10 pro 100 000 mit insgesamt fallender Tendenz seit mehreren Jahrzenten (Ursache unbekannt). Typischerweise sind vor allem männliche Jugendliche zu Beginn des pubertären Wachstumsschubes betroffen. Das Verhältnis von Jungen zu Mädchen beträgt etwa 3:1.
Verlaufsformen der Epiphyseolysen
Vom Verlauf her werden akute Epiphyseolysen von chronisch verlaufenden Formen mit langer Schmerzanamnese unterschieden. Die Symptomatik beider Formen unterscheidet sich stark. Typischerweise kann der Jugendliche mit einer akuten Form
das Bein nicht mehr belasten, derjenige mit einer chronischen Form zeigt meistens eine ausgeprägte Bewegungseinschränkung der Hüfte, aber relativ wenig Schmerzen.
Während bei der akuten Form eine vollständige Ablösung der Hüftkopfepiphyse vorliegt und damit eine ausgeprägte Instabilität, welche wiederum die Hüftkopfdurchblutung beeinträchtigt, kommt es bei der chronischen Form selten zur kompletten Ablösung. Hier verbreitert sich im Rahmen des schleichenden Prozesses initial die Wachstumsfuge, was auch radiologisch sichtbar ist, und in der Folge rutscht die Epiphyse entlang der Schenkelhalswachstumsfuge nach hinten ab. Eine häufige Form
ist die Mischform mit einer sogenannten akuten Epiphyseolyse, welche sich aus einem zuvor chronischen Verlauf entwickelt (acute-on-chronic), d. h. es besteht schon länger ein stabiler Verlauf, der wenig Beschwerden macht und anschliessend kommt es plötzlich zu einer Destabilisierung der Situation.
Symptomatik und Klinik
Meist klagen Patienten bereits über Monate (chronische Form) ohne initiales adäquates Trauma über Schmerzen in der Leiste, an der Vorderseite des Oberschenkels, aber auch im Bereich des Kniegelenkes. Dabei handelt es sich um einen projizierten
Schmerz. Man geht davon aus, dass die Beschwerden von der durch den Hüftkopfabrutsch veränderten Situation der Oberschenkelmuskulatur hervorgerufen werden. Leider ist es keine Seltenheit, dass diese Patienten mit mehrfach durchgeführten Röntgenbildern und teilweise sogar mit MRI-Untersuchungen der Knieglenke vorstellig werden. Die eigentlichen Leistenschmerzen treten eher selten auf, zeigen sich dann aber schnell bei der klinischen Hüftgelenksuntersuchung. Das Bein ist meistens in Rückenlage deutlich nach aussen rotiert, etwas verkürzt und bei Beugung des Hüftgelenkes kommt es zu dem sogenannten Drehmann-Zeichen – das Bein dreht bei Beugung des Hüftgelenkes nach aussen.
Diagnostik bei der Hüftkopfepiphysenlösung
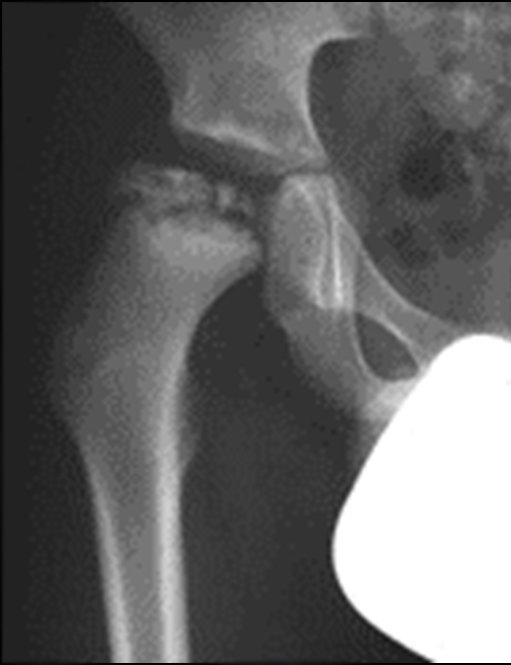
Die Sicherung der Diagnose erfolgt schon im Röntgenbild. Es zeigt sich meist in der Frontalaufnahme eine Aufweitung der Wachstumsfuge, je weiter der Hüftkopf bereits nach hinten abgerutscht ist, umso deutlicher zeigt sich auch die relative Höhenminderung des abgerutschten Kopfanteils (Abb. 7).
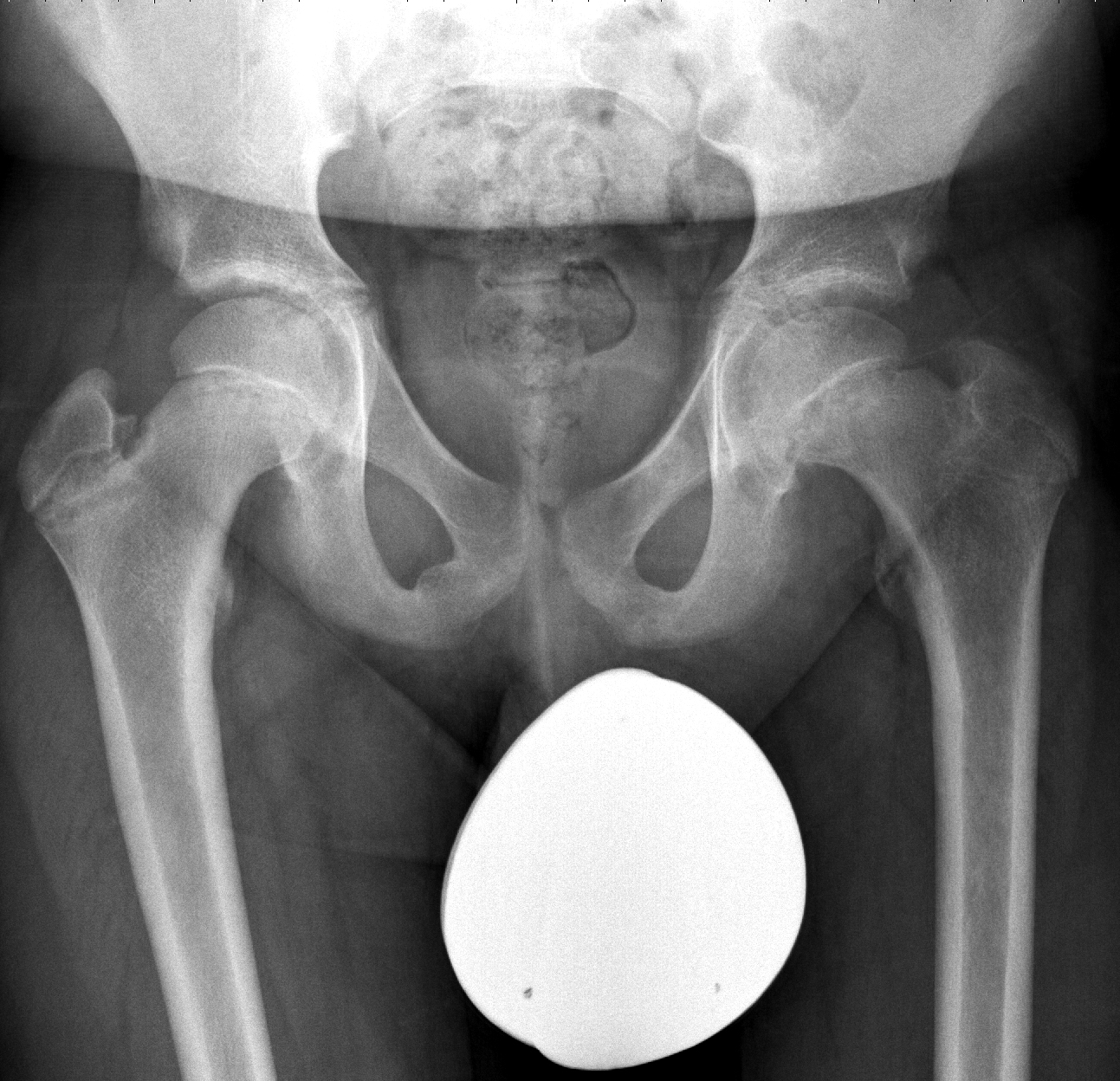

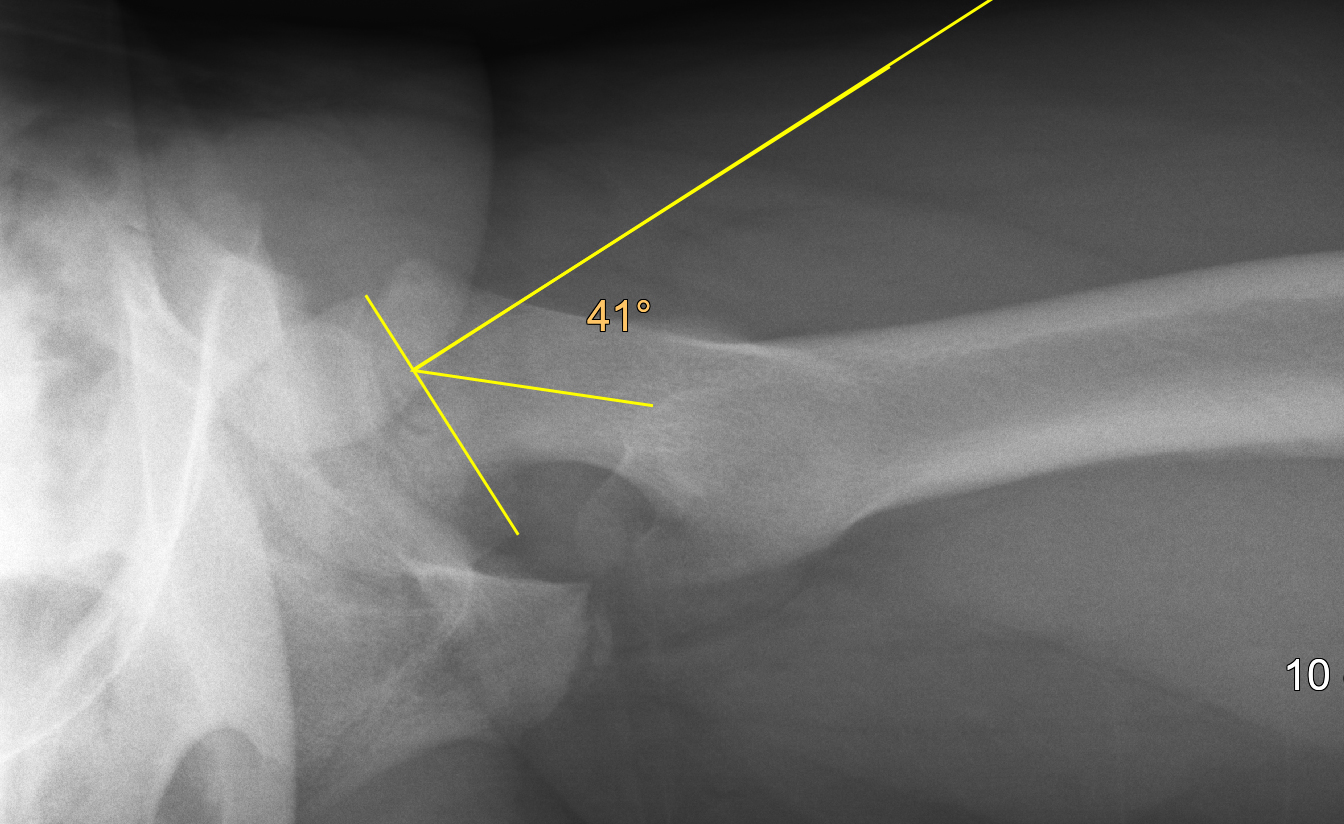
Hilfreich zur Diagnose eines Epiphysenabrutschs in der Beckenübersichtsaufnahme ist die sogenannte Klein-Tangente, welche lateral an den Schenkelhals angelegt wird (Abb. 8).
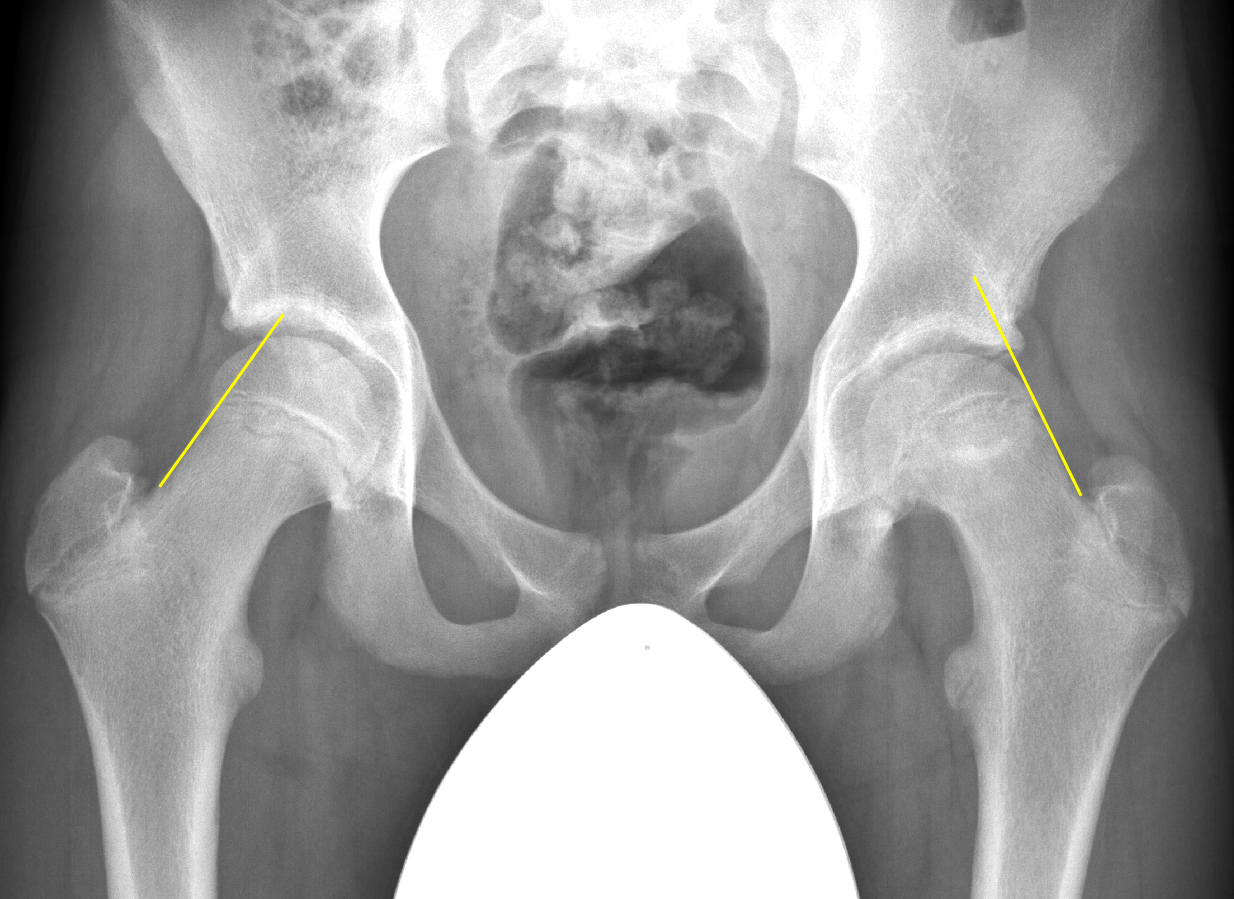

Bei einem Abrutsch schneidet diese auf der betroffenen Seite im Gegensatz zur gesunden Seite nicht oder in geringerem Mass den Hüftkopf. Eine zweite Ebene (Imhäuser-Aufnahme) zeigt dann den Abrutschwinkel in vollem Ausmass und der Abrutschwinkelgrad kann gemessen werden (Abb. 9).

In den meisten Fällen wird zusätzlich ein Arthro-MRI des Hüftgelenkes durchgefÜhrt, um eine möglicherweise bereits bestehende Hüftkopfdurchblutungsstörung sowie eventuelle Schäden an Labrum acetabulare und Gelenkknorpel beurteilen zu können.
Die Behandlung der Epiphysenlösung ist immer operativ
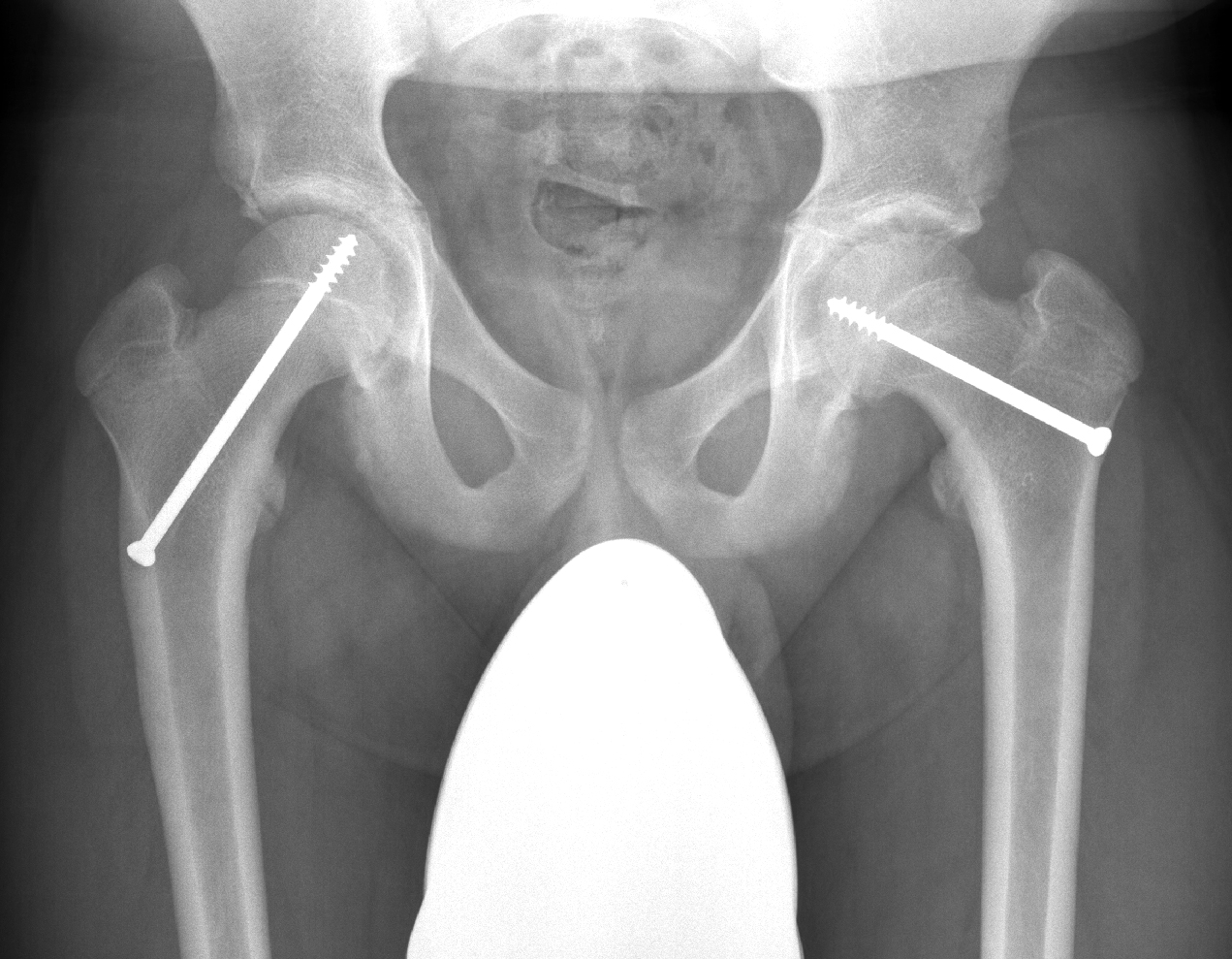
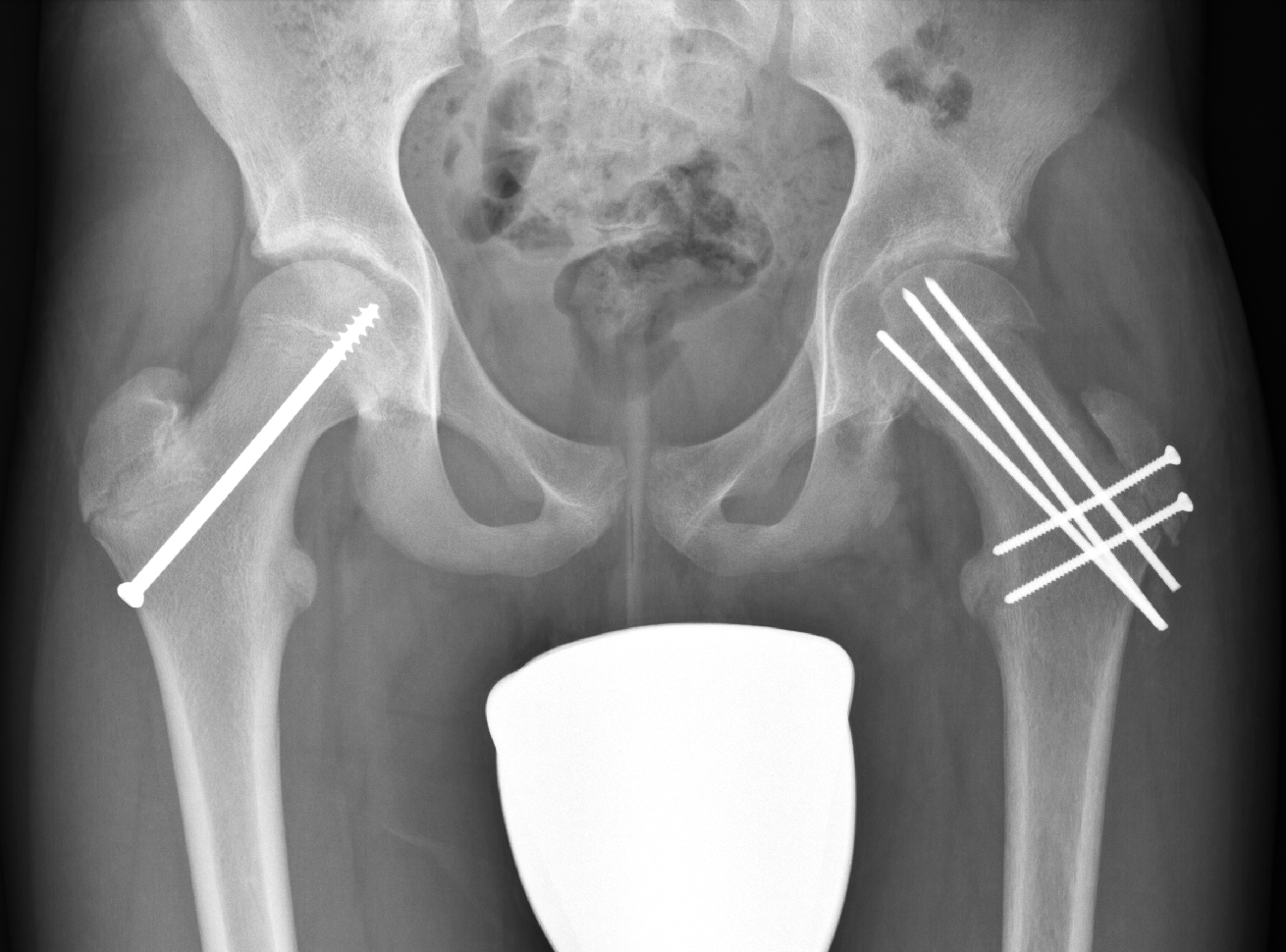
Jede Hüftkopfepiphysenlösung, ob chronisch oder akuter, muss operativ versorgt werden. Bei der chronischen Form sollte auf jeden Fall ein weiterer Abrutsch verhindert werden. Hierbei reicht bis zu einem Abrutschgrad von 15° bis 20° eine In-situ-Fixation aus, wobei je nach Alter des Patienten eine Fixation der Epiphyse mit Kirschnerdrähten oder mit Schrauben vorgenommen wird. Bei höherem Abrutschgrad ist eine alleinige Fixation nicht mehr ausreichend, da die Fehlstellung zu sekundären
Gelenkschäden und grösserer Funktionsbeeinträchtigung führt. In solchen Fällen erfolgt mit der Fixation zeitgleich eine arthroskopische Offset-Korrektur. Dabei wird der überstehende metaphysäre Anteil des Schenkelhalses analog zum Cam-Impingement beim Erwachsenen abgetragen.
Bei der akuten Form der Epiphysenlösung ist aufgrund der damit verbundenen Durchblutungsproblematik ein schnelleres Vorgehen erforderlich. Durch den Abrutsch der Epiphyse werden potentiell die schenkelhalsversorgenden Retinaculumgefässe
geschädigt und können sogar abreissen. Deshalb sollte bei instabiler Epiphyseolyse sofort operativ vorgegangen werden. Sowohl bei der akuten Form, als auch beim schweren chronischen Abrutsch erfolgt dann die offene Einstellung des Hüftkopfes auf
den Schenkelhals. Hierbei ist die korrekte Präparation der Weichteile am hinteren Schenkelhalsbereich besonders wichtig, in dem die Retinaculumgefässe verlaufen. Sind die Gefässe beschädigt, kann sich eine Hüftkopfnekrose entwickeln. Ob die Gegenseite, die meistens nicht betroffen ist, ebenfalls zu verschrauben ist, wird kontrovers diskutiert. In den meisten Fällen empfiehlt sich diese gegenseitige Verschraubung, einerseits um das Risiko zu minimieren, dass es auch hier zu einem Abrutsch
kommt, andererseits auch, um das Wachstum am proximalen Femur zu bremsen, da sonst doch eine beträchtliche Beinlängendifferenz resultieren kann, da üblicherweise die primär betroffene Wachstumsfuge nicht mehr weiterwächst (Abb. 10 und 11).


Nachbehandlung und Ergebnisse
Je nach operativem Vorgehen ist eine Teilbelastung an Gehstöcken zwischen 2 und 6 Wochen erforderlich. Eine begleitende Physiotherapie wird üblicherweise durchgeführt, ebenso regelmässige Röntgenkontrollen. Die Ergebnisse sind insgesamt sehr gut. Trotzdem muss gesagt werden, dass insbesondere bei den schweren Verläufen ein Hüftkopfnekrose nicht ausgeschlossen ist und weitere Eingriffe notwendig sein können. Das eingebrachte Material wird meistens nach 1–2 Jahren wieder entfernt.
In welchem Umfang nach dieser Erkrankung wieder Sport betrieben werden kann, ist eine Einzelfallentscheidung. Eine «normale» sportliche Betätigung ist aber normalerweise wieder problemlos möglich.
Avulsionsverletzungen des Beckens
Avulsionsverletzungen am Becken entstehen durch plötzliche oder dauerhafte übermässige Zugbelastung auf die entsprechenden Muskelansätze, typischerweise bei Stop & Go-Sport wie beim Fussball, Basketball oder Unihockey, aber auch durch einen
heftigen Kick oder Ausfallschritt. Meist sind Jugendliche im Pubertätsalter betroffen, häufig besteht ein Zusammenhang mit muskulären Verkürzungen.
Lokalisationen und Kennmuskeln
• Spina iliaca anterior superior (Musculus sartorius)
• Spina iliaca anterior inferior (Musculus rectus femoris)
• Trochanter minor (Ansatz des M. psoas)
• Tuber ischiadicum = Sitzbeinhöcker (Ansatz der Ischiocruralmuskeln)
• Os pubis = Schambeinast (Ansatz der Adduktorenmuskeln)
Beschwerden und Befunde
Die Jugendlichen beklagen lokalisierte belastungsabhängige Schmerzen und Druckdolenz an den jeweiligen Muskelansätzen. Im Röntgen lassen die Läsionen sich meist bereits erkennen, zur Bestimmung des Diskolationsgrads kann ergänzend eine
MRI-Diagnostik durchgeführt werden.
Therapie
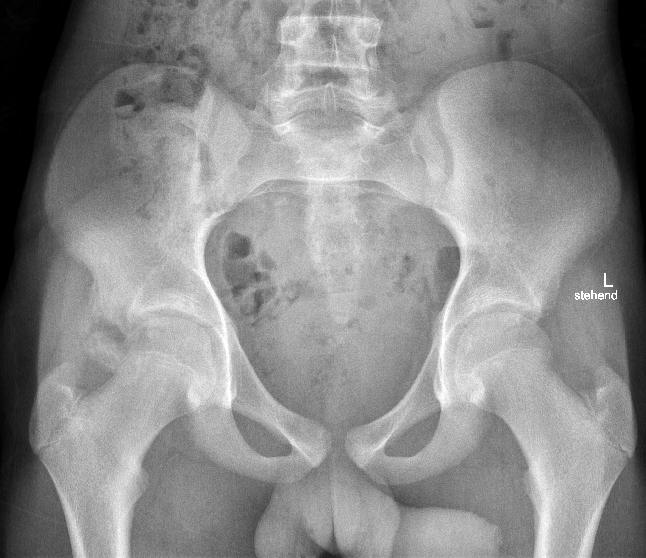
In der Regel wird eine konservative Behandlung durchgeführt mit 6 Wochen Teilbelastung, Physiotherapie und 3 bis 4 Monaten Einschränkung von Lauf- und Sprungsportarten.
Bei starker Dislokation wird eine operative Versorgung (Reposition und Fixation des Fragments oder Fragmententfernung mit Anker-Refixation der Sehne) durchfgeführt (Abb. 12 und 13).

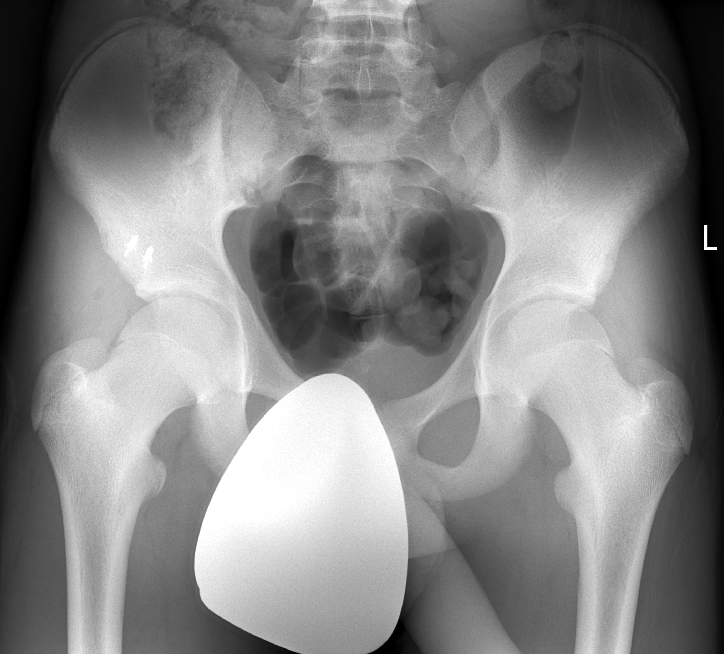

Hüft-Impingement
Durch forcierte Mobilisation der Hüftgelenke beim Sport wie Fussball, Tanzsport oder Kunstturnen kann es unter bestimmten Voraussetzungen zu einem Anschlagen des Schenkelhalses an den Rand der Hüftgelenkspfanne und damit zu einer Einklemmung der Weichteile insbesondere der Hüftgelenkslippe (Labrum acetabulare) mit daraus folgender Rissbildung kommen.
Vorbestehende anatomische Veränderungen wie:
• verminderte Schenkelhalstaillierung (Cam-Impingement)
• verstärkte Pfannenüberdachung (Pincer-Impingement)
• Torsionsanomalien am Oberschenkelknochen (femorale Retrotorsion) oder der Hüftpfanne begünstigen die Problematik. Langfristig kann ein frühzeitiger Gelenksverschleiss resultieren.
Beschwerden und Befunde
Die Patienten beklagen Schmerzen in der Leiste bei bestimmten Bewegungen und Belastungen des Hüftgelenkes. In der Untersuchung werden die Schmerzen typischerweise bei kombinierter Beugung, Innenrotation und Adduktion in der Hüftgelenksuntersuchung angegeben. Typische radiologische Merkmale zeigen sich im klassischen Röntgen des Beckens und einer zweiten axialen Aufnahme des Hüftgelenkes. Eine Arthro-MRI Untersuchung gibt weiteren Aufschluss vor allem über die Situation des Gelenkknorpels und des Labrum acetabulare.
Behandlung
Bei jungen Patienten gilt es als erstes, die auslösenden Bewegungen dauerhaft zu meiden. Physiotherapeutische Massnahmen sind ebenfalls hilfreich. In einigen Fällen wird auch eine Infiltration des Hüftgelenkes durchgeführt (therapeutisch und diagnostisch). Sind die anatomischen Veränderungen sehr ausgeprägt und die konservativen Therapiemassnahmen ausgeschöpft, ist allenfalls eine operative Korrektur notwendig. Die chirurgischen Massnahmen reichen von einer arthroskopischen Korrektur der Offsetstörung bis zu knöchernen Korrekturen am Becken (Periacetabuläre Osteotomie) und am Femur (Derotationsosteotomie).
Psoasschnappen (Coxa saltans interna)
Bei ungenügender Beckenstabilisierung, insbesondere in den Wachstumsschüben – mit der daraus resultierenden Verkürzung der Hüftbeuger – kann es bei Lauf- und Sprungsportarten wie Fussball, Unihockey und Leichtathletik zum Schnappen der Sehne des kräftigsten Hüftbeugers (Psoasmuskel) kommen.
Beschwerden und Befunde
Die Jugendlichen beklagen ein teils schmerzhaftes Schnappen in der Leiste bei Extensions-Flexions- sowie Drehbewegungen. Typisch bei der klinischen Untersuchung ist die Auslösung des Schnappens durch Extension der abduzierten Hüfte aus tiefer
Flexion heraus sowie eine Druckdolenz über dem Psoas auf Höhe des Hüftgelenks.
Behandlung
Die Behandlung ist konservativ mit Dehnung der Hüftbeuger und Stabilisation des Beckengürtels. Die sportliche Belastung sollte an die Schmerzen adaptiert werden.
Schnellende Hüfte (Coxa saltans externa)
Das Springen der Sehnenplatte über dem (Trochanter major) entsteht meist im Wachstumsschub durch eine ungenügende Beckenstabilisierung und Verkürzung der äusseren Oberschenkelmuskeln. Prädisponierend ist ein lateral prominenter Trochanter major bei Coxa vara, welcher als Hypomochlion wirkt. Nicht selten entsteht durch das Reiben des Tractus iliotibialis über dem Trochanter eine Entzündung des Schleimbeutels (Bursitis trochanterica).
Beschwerden und Befunde
Die meist weiblichen Jugendlichen beklagen anfänglich ein Schnappen über dem äusseren Hüftknochen, das oft als «Aushängen» der Hüfte interpretiert wird. Mit der Zeit löst dieses Schnappen auch Schmerzen aus. Viele können dieses Schnappen bewusst auslösen. Häufig besteht eine ungenügende Stabilisierung des Beckens (Absinken auf der Schwungbeinseite). Bei starker Reizung kommt es auch zu Schmerzen beim Liegen auf der entsprechenden Seite.
Behandlung
Durch Dehnung von Tractus iliotibialis bzw. M. tensor fasciae latae und Kräftigung der Gesässmuskeln, welche das Becken stabilisieren, verschwinden bei den meisten Patienten die Schmerzen und das auslösende Schnappen. Operative Massnahmen sind sehr zurückhaltend anzuwenden. Auch hartnäckig persistierende Schmerzen sistieren mit der Zeit meist spontan.
Patellaluxation
Bei den meisten Patellainstabilitäten, welche wir in der Praxis sehen, handelt es sich um akute oder rezidivierende Patellaluxationen auf dem Boden einer Prädisposition. Traumatische Patellaluxationen, d. h. durch adäquate Traumata hervorgerufene Dislokationen ohne prädisponierende Faktoren, sind bei Kindern und Jugendlichen selten. Am häufigsten treten Luxationen bei vorbestehenden morphologischen Risikofaktoren im Rahmen eines kleineren Traumas oder Fehltritts auf, typischerweise bei Adoleszenten, deutlich gehäuft bei Mädchen. Angeborene Patellaluxationen sieht man meist im Rahmen von übergeordneten Syndromen wie z. B. Patella-Nail-Syndrom. Chronische Patellaluxationen im Kindesalter gehen in der Regel auf eine hochgradige Bindegewebslaxität bei übergeordneten Erkrankungen zurück.
Prädisponierende Faktoren für eine Patellainstabilität
• Bandlaxität (familiär, Kollagenerkrankungen wie z. B. bei Ehlers-Danlos-Syndrom, Trisomie 21 und anderen)
• Trochleadysplasie (ungenügende knöcherne Führung der Patella durch vor allem proximal zu flach ausgeformte Trochlea femoris und hypoplastische laterale Trochleafacette)
• Patellahochstand (eine zu weit proximal platzierte Patella hat in strecknaher Position ungenügenden Kontakt zur patellaführenden Trochlea femoris)
• Genua valga, erhöhter Q-Winkel (Winkel zwischen Quadriceps und Patellasehnenlängsachse): Es resultiert daraus ein lateralisierender Kraftvektor auf die Patella.
• Erhöhte TT-TG-Distanz (seitlicher Versatz der Tuberositas tibiae im Bezug auf den tiefsten Punkt der Trochlea). Die Wirkung des Quadricepszugs führt zu einer Patellalateralisierung.
Beschwerden und Befunde
Die Patellainstabilität wird meist als plötzliches Nachgeben oder «Aushängen» beschrieben, typischerweise bei Belastung des Beins in leichter Flexion, Valgus und Aussenrotation. Teilweise wird eine komplette oder inkomplette Luxation der Patella
beobachtet. In der Regel kommt es zu einer spontanen Reposition bei Kniestreckung. Vor allem bei Erstluxationen kann ein ausgeprägter Hämarthros entstehen durch die Verletzung des medialen Retinaculums oder osteochondrale Abscherverletzungen. Rezidivierende Luxationen gehen häufig nicht mit einem Gelenkerguss einher, das Risiko für akute Begleitverletzungen sinkt. Klinisch zeigt sich eine vermehrte passive Lateralisierbarkeit der Patella sowohl in Streckung wie auch
in 30 ° Knieflexion, oft verbunden mit einer reflektorischen muskulären Gegenspannung, dem sogenannten «Apprehension-Zeichen». Bei unauffälligem Befund sollte in 30 ° Flexion bereits eine passive Stabilisierung durch die Trochlea eintreten, welche bei Trochleadysplasie oder Verletzung der medialen Stabilisatoren verringert ist. Bei Anspannung der Oberschenkelmuskulatur beobachtet man oft eine ausgeprägte Patellalateralisierung, das sogenannte «Scheibenwischerphänomen». Ein pathologischer Q-Winkel oder Genua valga verstärken diesen Effekt.
Bildgebende Diagnostik
Standardmässig werden Röntgenbilder in a.-p. und seitlicher Projektion sowie eine Patellatangentialaufnahme in 30–40 ° Flexion angefertigt. Abgescherte osteochondrale Fragmente werden als freie Gelenkkörper sichtbar. Die a.-p.-Aufnahme zeigt oft
eine Patellalateralisierung. Die seitliche Aufnahme sollte, wenn möglich, in 90° Flexion angefertigt werden. Steht der Patellaoberpol deutlich höher als die Tangente an die dorsale Femurbegrenzung, ist dies ein Zeichen für einen Patellahochstand. Dieser kann auch mittels verschiedener Messtechniken (z. B. Insall-Salvati-Index, Quotient aus Patellalängsausdehnung und Abstand Patellaunterpol zur Tuberositas tibiae, Normwert 1,0, pathologisch ab 20 % Abweichung), beurteilt werden. Im exakt seitlichen Röntgenbild zeigt sich die Trochleadysplasie durch eine supratrochleäre Vorwölbung («bump») und das «crossing sign» (die Trochlea endet distal der Epiphysenfuge).
Ein ergänzendes MRI ermöglicht die Diagnose von Zerreissungen des medialen Retinaculums oder chondraler Läsionen, welche im Röntgen nicht sichtbar sind. Typisch sind Kontusionsödeme am lateralen Femurcondylus und der medialen Patellafacette. An diesen Lokalisationen können auch chondrale Abscherverletzungen bis hin zum freien chondralen Flake entstehen und im MRI diagnostiziert werden. Insbesondere nach einer Erstluxation empfiehlt es sich, ein MRI anzufertigen, da mit behandlungsbedürftigen Begleitverletzungen wie Flake-Frakturen gerechnet werden muss.
Therapie der Patellaluxation
Erstluxationen werden konservativ behandelt, solange keine operationsbedürftigen Begleitverletzungen vorliegen. Neben physiotherapeutischer Quadricepsaktivierung kommt der Behandlung mit einer Knieorthese mit lateraler Patellaführung hierbei
grosse Bedeutung zu. Meist wird das Knie für 2 Wochen in 0–10 ° Streckstellung fixiert und dann die freigegebene Flexion über 4 Wochen langsam gesteigert. Auf diese Weise wird eine optimale Heilung des elongierten medialen Retinaculums gewährleistet.
Operative Therapie
Flakerefixation
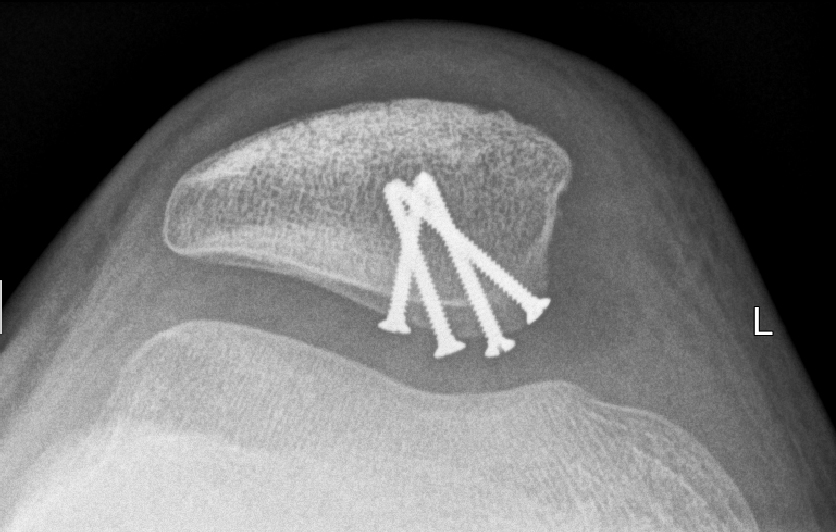
Chondrale oder osteochondrale Flakes sollten, wenn möglich, refixiert werden. Die Refixation erfolgt durch Schrauben, welche man sekundär wieder entfernt. Auch rein chondrale Fragmente heilen bei Jugendlichen in der Regel erfolgreich ein (Abb. 14
bis 17).
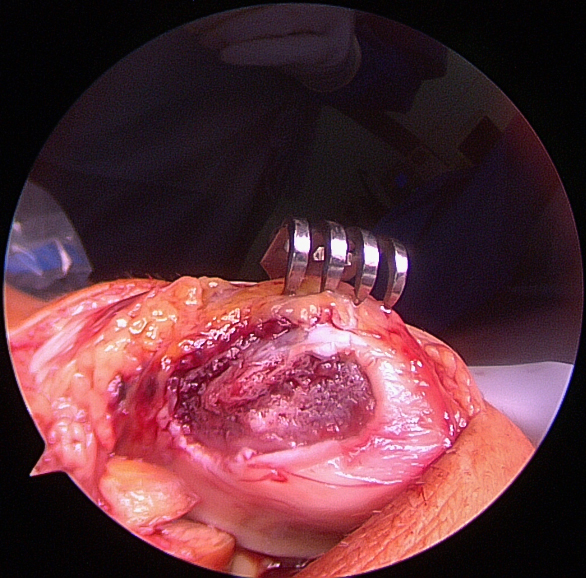

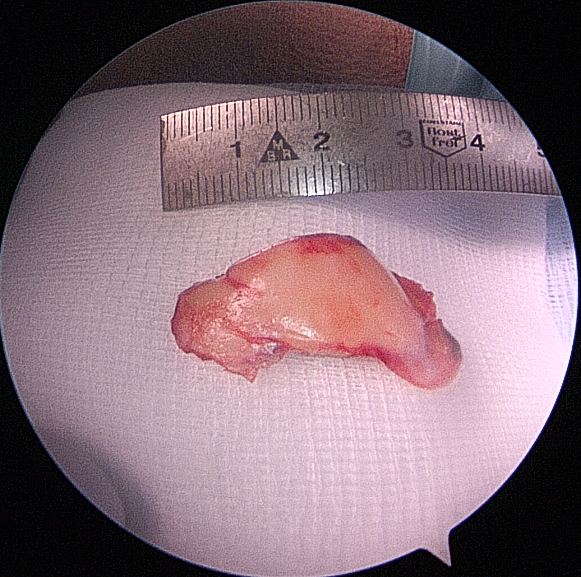

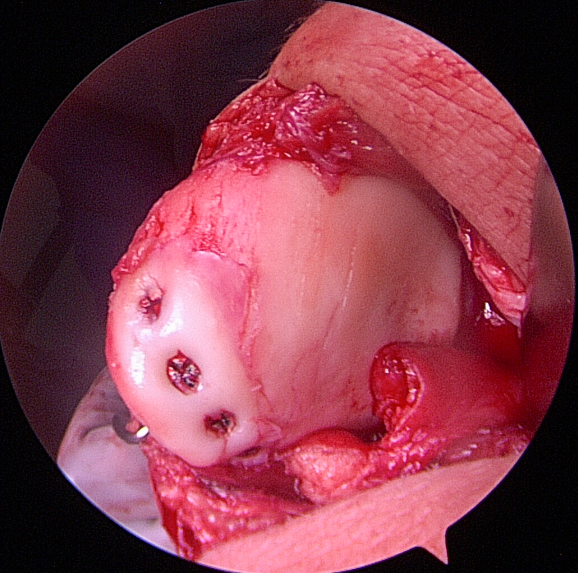


Weichteilige Techniken
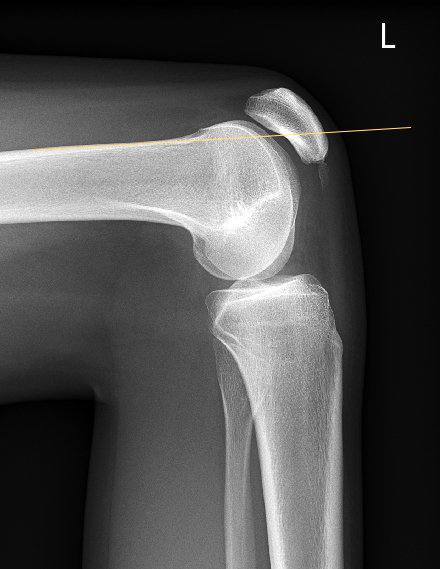
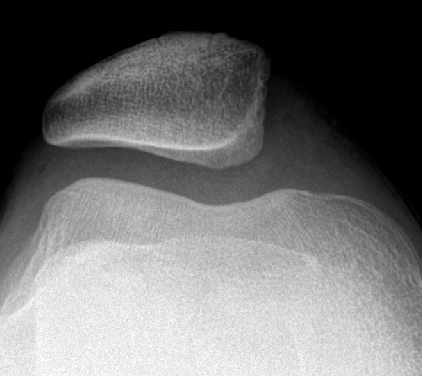
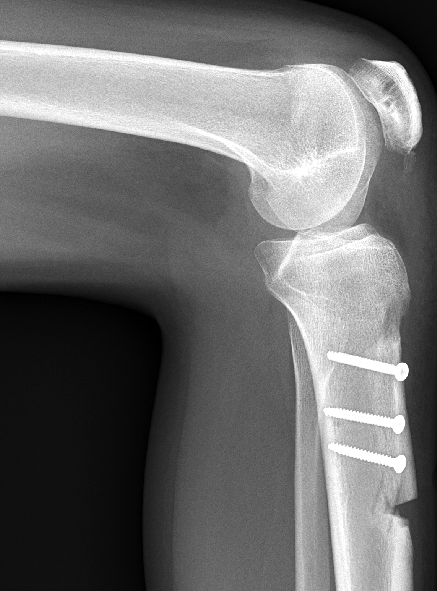
Bei noch offenen Wachstumsfugen werden primär weichteilige Operationsverfahren gewählt, da ossäre Korrekturen die Wachstumsfugen verletzen würden. Zur Reduktion der Patellalateralisierung kann das laterale Retinaculum gespalten werden. Die medialen Strukturen werden im Gegenzug dosiert gerafft, um eine gute Balancierung der Kräfte zu erreichen. Hierzu sind vielfältige Methoden beschrieben. Gebräuchlich ist die Naht und Raffung des medialen Retinaculums, gegebenenfalls mit zusätzlicher Augmentation. Das sogenannte MPFL (mediales patellofemorales Ligament), eine Verdickung im medialen Retinaculum, kann durch einen Sehnenstreifen (Semitendinosussehne, Quadricepssehne) verstärkt werden, sog. «MPFL-Plastik». Eine anatomische femorale Fixation ist aber erst nach Wachstumsfugenschluss möglich. Bei den genannten medialen Strukturen handelt es sich um passive Stabilisatoren. Der M. vastus medialis als aktiver «Patellamedialisator» wird bei der Prozedur nach Insall an der Patella abgelöst und weiter distal verankert und gespannt, wodurch sich die muskuläre Patellastabilisierung verbessert. Bei sorgfältiger Nachbehandlung unter sukzessiver Steigerung der Knieflexion über 4–6 Wochen können die weichteiligen Techniken erfreuliche Ergebnisse liefern (Abb. 18 bis 20).



Ossäre Techniken
Bei schweren Patellainstabilitäten und verschlossenen Wachstumsfugen werden ergänzend knöcherne Operationen zur individuellen Korrektur anatomischer Pathologien diskutiert. Liegt eine Patella alta und/oder eine Lateralisierung
der Tuberositas tibiae vor, wird dies mittels Tuberositasosteotomie behandelt. Entsprechend der Pathologie wird die Tuberositas tibiae, nachdem sie mit einer oszillierenden Säge mobilisiert wurde, nach distal und/oder medial versetzt und mit Schrauben refixiert. Auf diese Weise kann ein Patellahochstand korrigiert und die Zugrichtung des Streckapparats normalisiert werden.
Bei schwerster Trochleadysplasie und im Rezidivfall kann eine sogenannte Trochleaplastik erfolgen. Die Trochlea femoris wird nach sorgfältigem Präparieren und Anheben einer Knorpel-Knochenschicht der Trochlea mit einer Fräse vertieft und die Knorpel-Knochenlamelle dann anmodelliert und mit Fäden refixiert, sodass sie knöchern wieder anheilen kann.
Ossäre Begleitpathologien
Genua valga und vermehrte femorale Antetorsion zählen als weitere Faktoren für Patellalateralisierung. Entsprechende Korrekturen können im Rahmen der operativen Therapie ergänzend erfolgen (Wachstumslenkung durch Hemiepiphyseodese,
z. B. mittels 8-Plates, Rotationskorrekturen).
Erfolgsaussichten
Je mehr der eingangs genannten Risikofaktoren für Patellainstabilität vorliegen, umso geringer sind die langfristigen Erfolgsaussichten für eine konservative Therapie. Aber auch die Erfolge bei operativem Vorgehen werden durch die Risikofaktoren definiert. Die Herausforderung im Alltag besteht darin, individuell die notwendigen Massnahmen zu ergreifen, ohne aber unnötig ausgedehnte Operationen durchzuführen. Grundsätzlich sind die knöchernen Verfahren wirkungsvoller, aber invasiver, und sie können erst nach Wachstumsfugenschluss angewendet werden.
Morbus Osgood-Schlatter
Der Morbus Osgood Schlatter ist eine typische Erkrankung von pubertierenden Jugendlichen im Wachstumsschub, welche leicht gehäuft bei Jungen auftritt. Es handelt sich um eine Reizung im Bereich der noch nicht vollständig ossifizierten Tuberositas tibiae-Apophyse, welche im Rahmen repetitiver (Über-) Belastung durch den Zug der dort ansetzenden Patellasehne entsteht. Es werden neben der rein mechanischen Ursache auch hormonelle Einflussfaktoren diskutiert, ebenso wie das Vorliegen einer aseptischen Osteonekrose. Der Krankheitsverlauf erstreckt sich typischerweise über 1–2 Jahre, mit wechselnd stark ausgeprägter Symptomatik.
Klinische Symptomatik und Diagnosestellung
Typischerweise sind Beschwerden vor allem am Ende oder nach sportlicher Belastung. Manchmal werden sie auch durch ein konkretes Trauma wie einen direkten Anprall erstmals ausgelöst. Die Patienten bemerken eine zunächst teigige Schwellung,
später kann sich auch eine echte knöcherne Prominenz der Tuberositas entwickeln. Es besteht meist eine ausgeprägte Druckschmerzhaftigkeit, und im akuten Stadium Schmerzen bei passiver Knieflexion oder Extension gegen Widerstand. Wir beobachten häufig auch eine begleitende, wahrscheinlich durch das schnelle Knochenwachstum bedingte Verkürzung der Rectus femoris-Muskulatur, welche den Zug an der Apophyse funktionell verstärkt, sich aber möglicherweise auch sekundär
im Krankheitsverlauf entwickelt.
In der Regel kann die Diagnose eines Morbus Osgood-Schlatter bereits klinisch gestellt werden. Wichtig ist es, eine – selten vorkommende – Avulsion und Dislokation der Tuberositas Tibiae-Apophyse nicht zu verpassen. Diese geht mit massiven Schmerzen und ggf. auch einer Beeinträchtigung der Extensionskraft einher.
Wird eine Bildgebung durchgeführt, achtet man vor allem in der seitlichen Röntgenaufnahme des Kniegelenks auf eine mögliche Abhebung oder Fragmentierung der Apophyse. Im Krankheitsverlauf können sich auch freie Ossikel im proximalen Patellasehnenansatzbereich entwickeln, welche mitunter langfristig störend sein können. Ein ergänzendes MRI des Kniegelenks, welches nur in seltenen Fällen benötigt wird, zeigt typischerweise einen ödematösen Reizzustand von Apophyse, Ossikeln und der umgebenden Weichteile.
Therapie
Die Behandlung eines Morbus Osgood-Schlatter ist in aller Regel konservativ, der Spontanverlauf ist günstig. Wichtig ist es, die betroffenen Patienten diesbezüglich gut zu informieren.
Im akuten Schmerzzustand wird lokal antiphlogistisch mittels Kälteapplikation und NSAR-Pflastern behandelt. Nur selten sind systemische Schmerzmittel erforderlich. Lokale Injektionen werden nur äusserst selten durchgeführt, wobei insbesondere Kortisoninjektionen obsolet sind. Die Patienten sollten die Sportaktivität bis zum Abklingen der akuten Schmerzen pausieren und dann beschwerdeadaptiert wieder steigern. Meist gelingt es gut, die eigene Belastungsgrenze zu erlernen und so Schmerzspitzen zu vermeiden. Eine temporäre Stockentlastung oder Ruhigstellung in einer Knieorthese kann in Einzelfällen nötig sein. Es existieren auch physiotherapeutische Konzepte, welche die Verkürzung des Streckapparats begleitend behandeln und das Zusammenspiel der knieumgreifenden Muskulatur verbessern.
In seltenen Fällen ist eine operative Therapie indiziert bei Ausbildung persistierender freier Ossikel oder einer scharfen ossären Kante am Oberrand der Tuberositas tibiae, welche als pathologisches Hypomochlion für die Patellasehne wirkt. In diesen Fällen kann über eine paraligamentäre Inzision eine Ossikelentfernung und Knochenkantenglättung durchgeführt werden. Die Patellasehne und die eigentliche Insertion werden hierbei nicht tangiert. Sport ist in der Regel nach Ablauf von 6 Wochen wieder möglich.
Aufgrund der Nähe zur Wachstumsfuge sollten solche Eingriffe erst am Wachstumsende durchgeführt werden (Abb. 21 und 22).


Morbus Sinding-Larsen-Johansson und Patellaspitzensyndrom
Dieses Krankheitsbild tritt häufig bei Überlastung des Streckapparates auf, also bei Lauf- und Sprungsportarten wie Fussball, Basketball, Volleyball und Leichtathletik. Es kommt zu Mikrotraumatisierungen der Sehne im Ansatzbereich des Kniescheibenunterpols, in der Folge entsteht eine Entzündung und teilweise eine Ossifikation an dieser Lokalisation. Auch wird eine analoge Genese wir beim M. Osgood-Schlatter (aseptische Osteonekrose im Bereich des Patellaunterpols) diskutiert.
Beschwerden und Befunde
Die Patienten beklagen belastungsabhängige Schmerzen am Patellaunterpol mit einer lokalisierten Druckschmerzhaftigkeit. Häufig findet sich eine verkürzte Quadrizepsmuskulatur. Beim Patellaspitzensyndrom ist das Röntgenbild unauffällig, beim
Sinding-Larsen-Syndrom finden sich die typischen Verkalkungen um den Kniescheibenunterpol.
Behandlung
Es empfiehlt sich, eine Sportpause von einigen Wochen einzuhalten. Hilfreich ist Physiotherapie mit Dehnung der Oberschenkelmuskulatur, Faszientechnik sowie lokal entzündungshemmenden Massnahmen.
Osteochondrosis dissecans
Bei der Osteochondrosis dissecans (OD) handelt es sich um eine lokalisierte aseptische Osteonekrose im Bereich des subchondralen Knochens. Jungen sind im Verhältnis 2:1 häufiger betroffen. Erkrankungsbeginn ist meist ab dem 10. Lebensjahr, wobei die Verläufe bei frühem Krankheitsbeginn (noch offene Wachstumsfugen) eindeutig günstiger sind als bei Erkrankungen am Ende der Pubertät.
Am Kniegelenk tritt die OD meist am lateralen Aspekt des medialen Femurcondylus auf, seltener lateral (dann oft im Zusammenhang mit einem lateralen Scheibenmeniskus), sowie vereinzelt im Bereich der Trochlea femoris oder der Patellarückfläche. Als Ursachen werden hereditäre Faktoren wie gestörte Aggrecan-Synthese, Kollagenstörungen und epiphysäre Dysplasien diskutiert. Bei den systemischen Formen können mehrere Gelenke betroffen sein, typischweise Knie, Sprunggelenk, Ellenbogen und Hüfte. Häufig liegen aber rein mechanische Ursachen wie repetitive Mikrotraumata zugrunde. Hierfür spricht die klare Häufung bei körperlich aktiven Jugendlichen. Nicht selten sind beide Kniegelenke betroffen.
Es werden insgesamt vier Krankheitsstadien entschieden, welche in Röntgen und MRI differenziert werden können.
• Stadium I: subchondrale Osteonekrose, Knorpel intakt
• Stadium II: Randsklerose des osteonekrotischen Herds, Knorpel intakt
• Stadium III: zunehmende Demarkation der OD, Knorpelerweichung im Randbereich mit im MRI progredientem Flüssigkeitssaum unterhalb der Läsion
• Stadium IV: Ablösung des Dissekats (freie Gelenkmaus)
Klinische Symptomatik und Diagnose
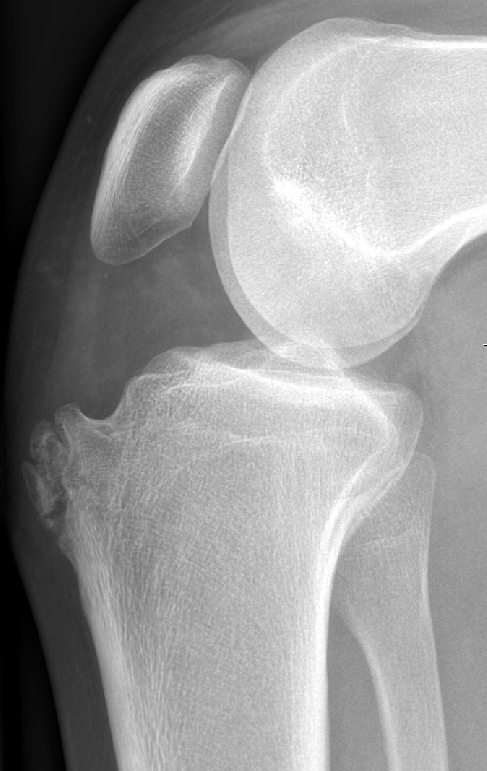
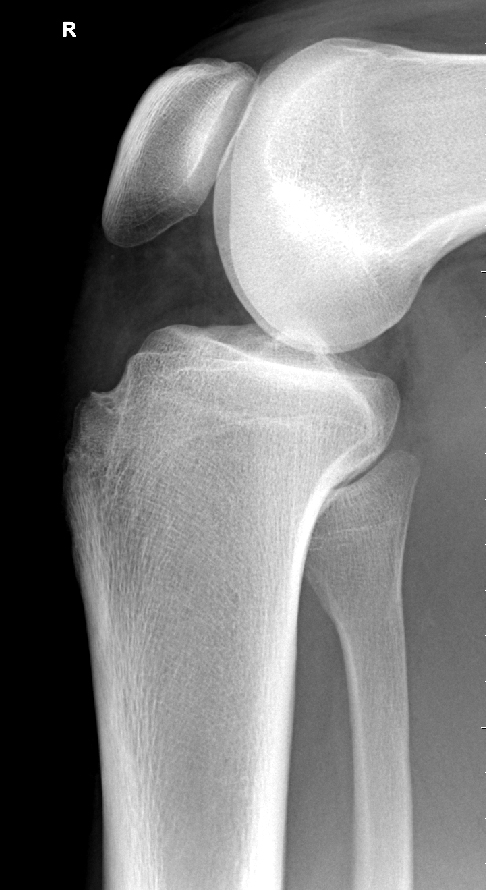
Die Patienten berichten regelhaft von stechenden, einschiessenden Schmerzen bei sportlicher Betätigung, welche häufig mit Blockadegefühlen einhergehen (Pseudoblockaden). Bei Fragmentdislokation kommt es zu echten mechanischen Gelenkblockaden. Die radiologische Diagnostik umfasst neben den beiden Standardebenen im Röntgen zusätzlich die Tunnelaufnahme nach Frick, welche den meist etwas dorsal am Femurcondylus gelegenen Herd besser tangential darstellen kann. Ergänzend kann dann ein MRI Informationen bezüglich beginnender Fragmentdemarkation und Lockerung sowie Knorpelschäden liefern, was für die weitere Therapieplanung wichtig ist (Abb. 23 und 24).
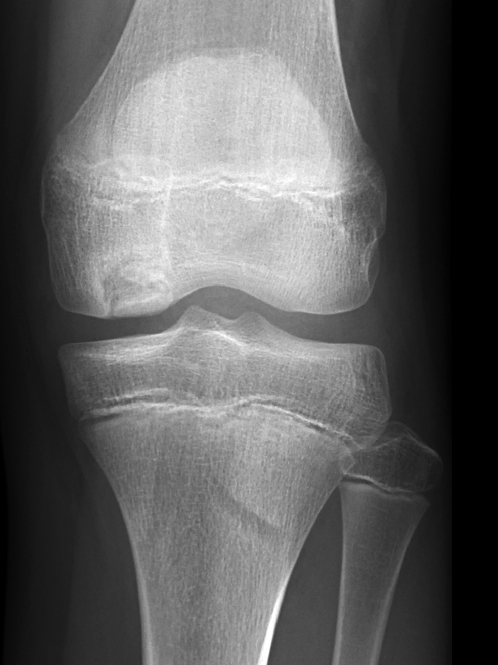

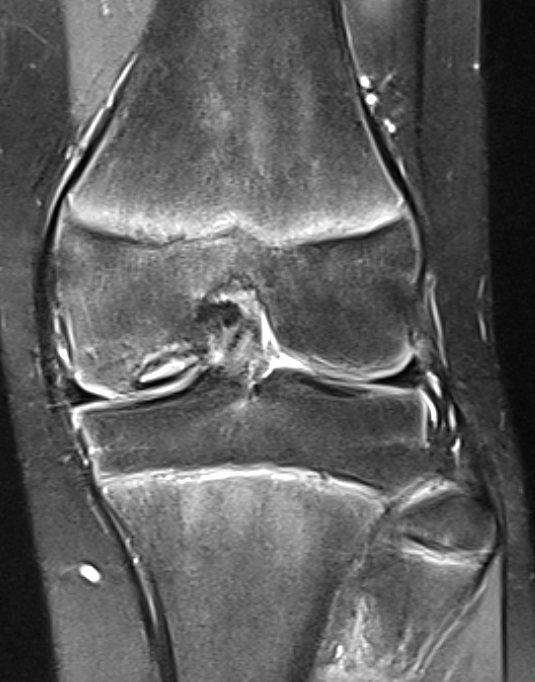

Stadienabhängige Therapie
Entscheidend für die weitere Therapie ist die Beurteilung der Stabilität des Fragments. Bei sicher stabilen Fragmenten, entsprechend den Stadien I und II, kann zunächst konservativ vorgegangen werden. Hierbei ist die Reduktion der Belastung bis hin zum Sportverbot als erstes zu nennen. Insbesondere sollten aufgrund der typischen Anatomie Drehbewegungen bei flektiertem Kniegelenk minimiert werden. Bei geeigneter Anwendung und Abklärung ist die Vitamin D Substitution sicherlich als ergänzende Therapiekomponente zu erwägen (auch wenn diese Massnahme in Fachkreisen kontrovers diskutiert wird). Röntgen- und ggf. MRI-Kontrollen werden zur Verlaufsbeobachtung alle 3-4 Monate durchgeführt. Bei stark symptomatischen ODs des Stadium II und beim Stadium III + IV wird eine operative Therapie durchgeführt. Hierbei kommen befundabhängig drei verschiedene Verfahren zum Einsatz.
Retrograde Herdspickung (Pridie-Bohrung)
Diese Technik kommt bei stabilen Läsionen zum Einsatz. Unter Bildwandlerkontrolle wird die Läsion perkutan retrograd mit Kirschnerdrähten gespickt (Abb. 25 und 26).
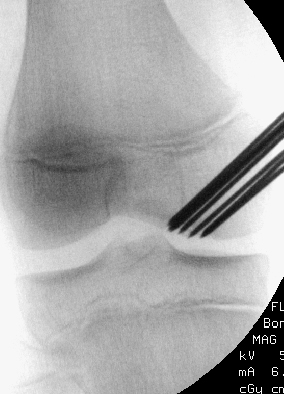

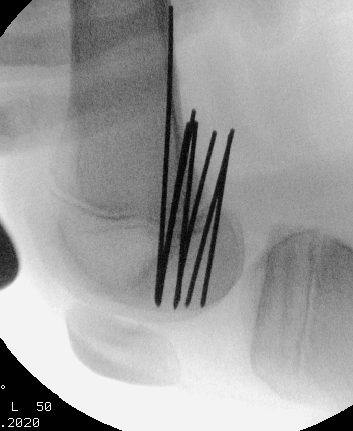

Diese perforieren die Sklerosezone und den avaskulären Grenzbereich zwischen Läsion und gesundem Knochengewebe. Hintergrund dieses Verfahrens ist die Annahme, dass durch die Bohrungen eine Heilungsstimulation erreicht wird, zum einen
durch die Durchbrechung der Sklerosezone mit potentieller Druckentlastung, zum anderen durch die Schaffung von Kanälen, durch welche Knochenmarkstammzellen in den Defektbereich einströmen und dort reparative Vorgänge in Gang setzen können. Ist man sich bezüglich der Stabilität der OD unsicher oder möchte die Knorpelqualität beurteilen, so wird diesem Eingriff in der gleichen Sitzung eine Arthroskopie vorgeschaltet mit visueller Beurteilung und Tasthakenprüfung der Fragmentstabilität. Bei guter Indikationsstellung sehen wir durch das beschriebene Vorgehen sehr schöne Erfolge.
Der Patient entlastet danach für 6 Wochen das Kniegelenk an Gehstützen, das weitere Vorgehen erfolgt entsprechend der weiteren Röntgen- und MRI-Verlaufskontrollen.
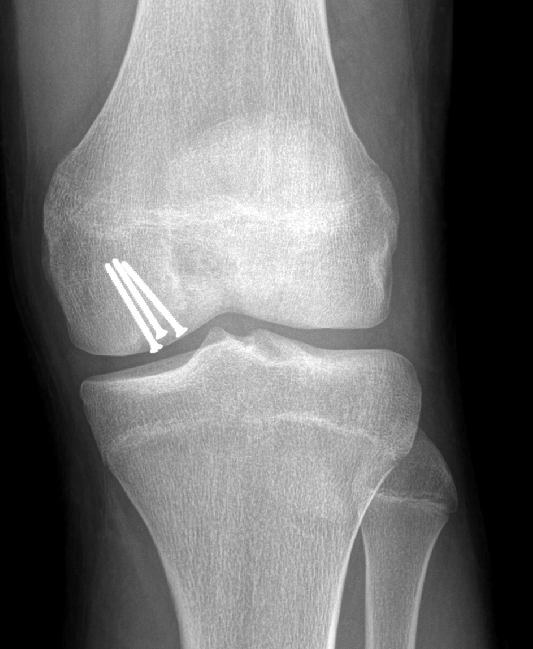
Offene Fragmentunterfütterung und Refixation
Bei ODs im Stadium III und IV ist es erforderlich, das sich lösende oder bereits ausgelockerte Fragment stabil zu refixieren, um eine Einheilung zu gewährleisten. Dieser Eingriff erfolgt über eine Miniarthrotomie des Kniegelenks, gegebenenfalls mit vorgängig arthroskopischer Bergung des abgelösten Fragments. Um gute Vorbedingungen für die Einheilung zu schaffen, wird das Defektbett bis zum gesunden Knochen debridiert, sowie auch die Rückseite der OD. Ist diese noch in situ, wird sie hierzu vorsichtig falltürartig abgelöst und aufgeklappt, ohne sie vollständig zu entfernen. Zur Stimulation der Einheilung wird das Fragmentbett dann mit autologer Spongiosa unterfüttert. Diese kann problemlos aus dem Calcaneus oder dem
Tibiakopf gewonnen werden. Die Refixation erfolgt standardmässig mit 2mm Stahlschrauben, welche unter Knorpelniveau versenkt werden. Nach ca. 4 Monaten können diese Schrauben dann wieder entfernt werden. Wir ziehen Stahlschrauben
resorbierbaren Schrauben oder Pins vor, da sie eine verlässliche Kompression über die gesamte Dauer gewährleisten und keine osteolytischen Abbaureaktionen hervorrufen (Abb. 27).

Knorpelersatzplastik
Bei Fällen, in denen keine Fragmentrefixation möglich ist, muss versucht werden, eine mechanisch wertige Ersatzknorpelbildung anzuregen. Bei kleineren Defekten kann man hierzu eine sogenannte Mikrofrakturierung durchführen, welche die Faserknorpelbildung anregt. Heute verwenden wir mit guten Ergebnissen aber meist autologe Knorpelchipsplastiken wie das AutoCart-Verfahren, welches eine Knorpelregeneration aus lokal eingebrachten und fixierten kleinfragmentierten autologen Knorpelchips ermöglicht und so auch grössere Defekte decken kann.
Bedeutung der Beinachse
Bei Osteochondrosis dissecans am medialen oder lateralen Femurcondylus ist es unerlässlich, auch die Beinachse zu analysieren und gegebenenfalls in die Behandlung mit einzubeziehen. Insbesondere die häufige Kombination einer OD am medialen Femurcondylus mit varischer Beinachse oder eine laterale OD mit Valgusachse (und ggf. lateralem Scheibenmeniskus) bedarf eventuell einer entsprechenden Achsenkorrektur, um den geschädigten Bereich zu entlasten. Bei offenen Wachstumsfugen kann im Rahmen der Operation der OD dann zeitgleich eine Wachstumslenkung durch Hemiepiphyseodese (temporär mit wachstumslenkenden Platten oder definitiv durch Canale-Bohrung) durchgeführt werden. Bei verschlossenen Wachstumsfugen muss im Einzelfall auch eine Korrekturosteotomie diskutiert werden.
Zusammenfassung
Die OD ist eine aseptische Osteonekrose, welche am häufigsten am medialen Femurcondylus auftritt. Erkankungsbeginn ab 10 Jahre, gehäuft bei sportlich aktiven Jungen. Die Prognose ist umso besser, je früher die OD auftritt. Bei bereits verschlossenen Wachstumsfugen ist die Möglichkeit der spontanen Abheilung sowie die Erfolgswahrscheinlichkeit der retrograden Anbohrung deutlich reduziert. Die Therapie erfolgt stadienabhängig, bis Stadium II meist konservativ, darüber operativ. Stabile Läsionen können retrograd angebohrt werden, instabile Läsionen müssen refixiert und mit autologer Spongiosa unterfüttert werden.
Femoropatellares Schmerzsyndrom
Insbesondere bei Mädchen zwischen 10 und 17 Jahren wird dieses Krankheitsbild häufig beobachtet.
Die Ursachen sind vielschichtig, so spielen sicher hormonelle Faktoren eine Rolle, aber auch das Wachstum mit der daraus resultierenden Dysbalance der Muskeln und Bänder und den veränderten Hebelarmen. Statische Faktoren wie Torsionsanomalien und Knicksenkfüsse beeinflussen die Beschwerden ebenfalls. Die Diagnose femoropatellares Schmerzsyndrom ist eine Ausschlussdiagnose, keine Verlegenheitsdiagnose bei unklaren Beschwerden, und
sollte erst dann gestellt werden, wenn alle anderen, strukturellen Ursachen für femoropatellare Beschwerden abgeklärt wurden.
Beschwerden und Befunde
Die Jugendlichen beklagen diffuse Schmerzen in den Weichteilen im Umfeld der Kniescheibe, mehrheitlich medial sowie Schmerzen bei Verschiebung und Kompression der Kniescheibe. Die Schmerzen sind oft relativ therapieresistent,
haben ohne ersichtliche Ursache begonnen und verschwinden in der späten Adoleszenz wieder.
Behandlung
Die Therapie ist konservativ mit Physiotherapie, Dehnung der an der Kniescheibe ansetzenden Muskeln und Kräftigung sowie auch Balancierung der vorderen und hinteren knieumgreifenden Muskulatur. Kniescheibenstabilisierende Bandagen sind oft
hilfreich. In ausgewählten Fällen können Schuheinlagen durch Verbesserung der Statik ebenfalls zur Schmerzlinderung beitragen.
Plica mediopatellaris-Syndrom
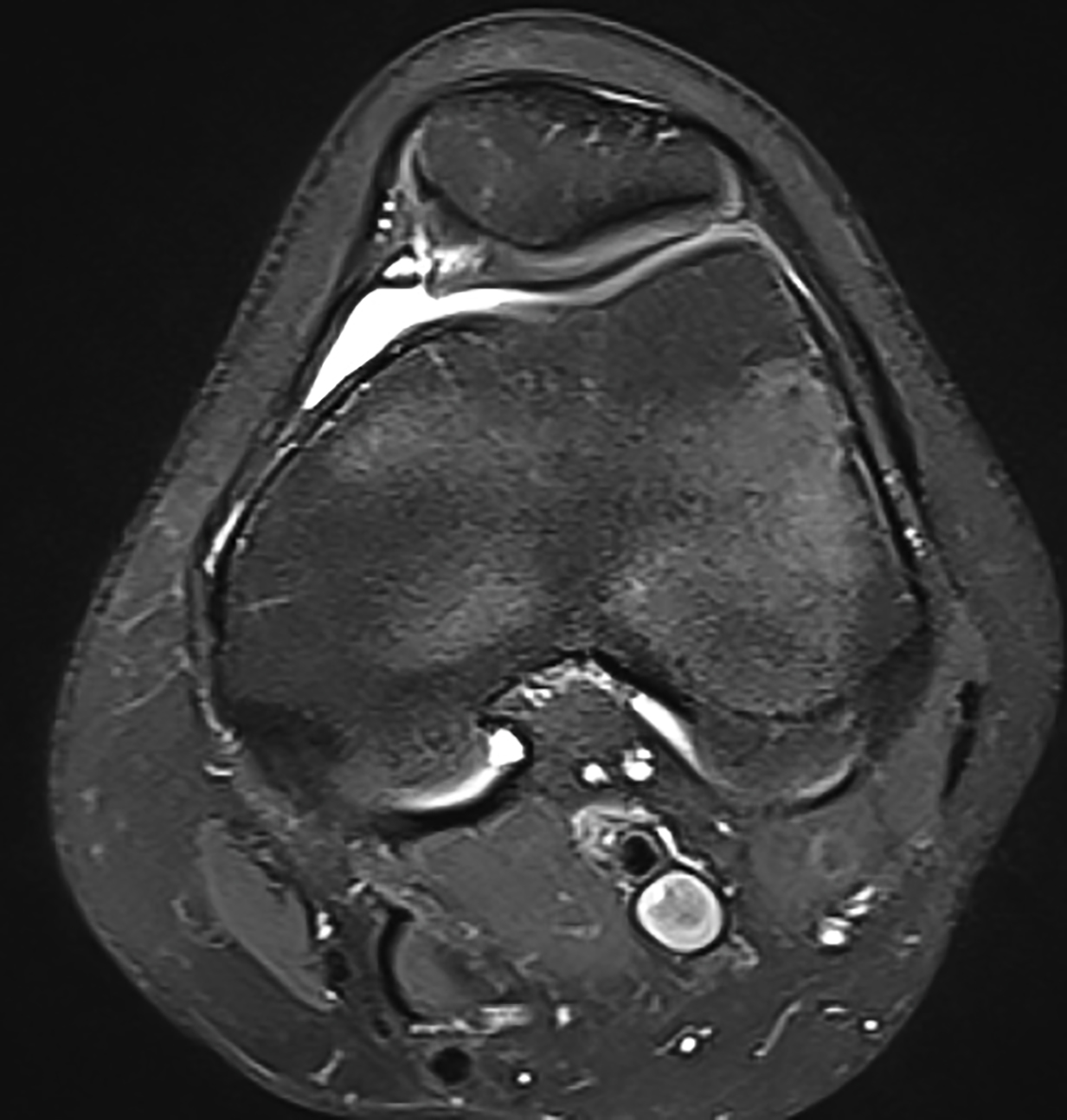
Die Plica mediopatellaris ist eine aus der Embryonalentwicklung verbleibende Falte der Gelenkschleimhaut auf der medialen Seite des Kniegelenks, die prinzipiell bei allen Menschen vorkommt. Jedoch nur bei einigen ist diese verdickt, vermehrt angespannt oder nach einem Trauma vernarbt und kann daher zwischen Kniescheibe und Gleitlager einklemmen.
Beschwerden und Befunde
Die Patienten beschreiben Schmerzen am Innenrand der Kniescheibe, teilweise tastet man dort einen druckschmerzhaften Strang. Die Plica kann so ausgeprägt sein, dass sie einen Knorpelschaden retropatellar oder am medialen Femurcondylus auslöst. Die Diagnose erfolgt klinisch und mittels MRI (Abb. 28).

Behandlung
Die Therapie ist primär konservativ mit Dehnung und Kräftigung der knieumgreifenden Muskulatur zur besseren Patellaführung. Kniebandagen und Gangschulung helfen ebenfalls. In therapieresistenten Fällen kann eine arthroskopische Entfernung der Plica und Behandlung der eventuellen Knorpelschäden indiziert sein (Abb. 29 und 30).
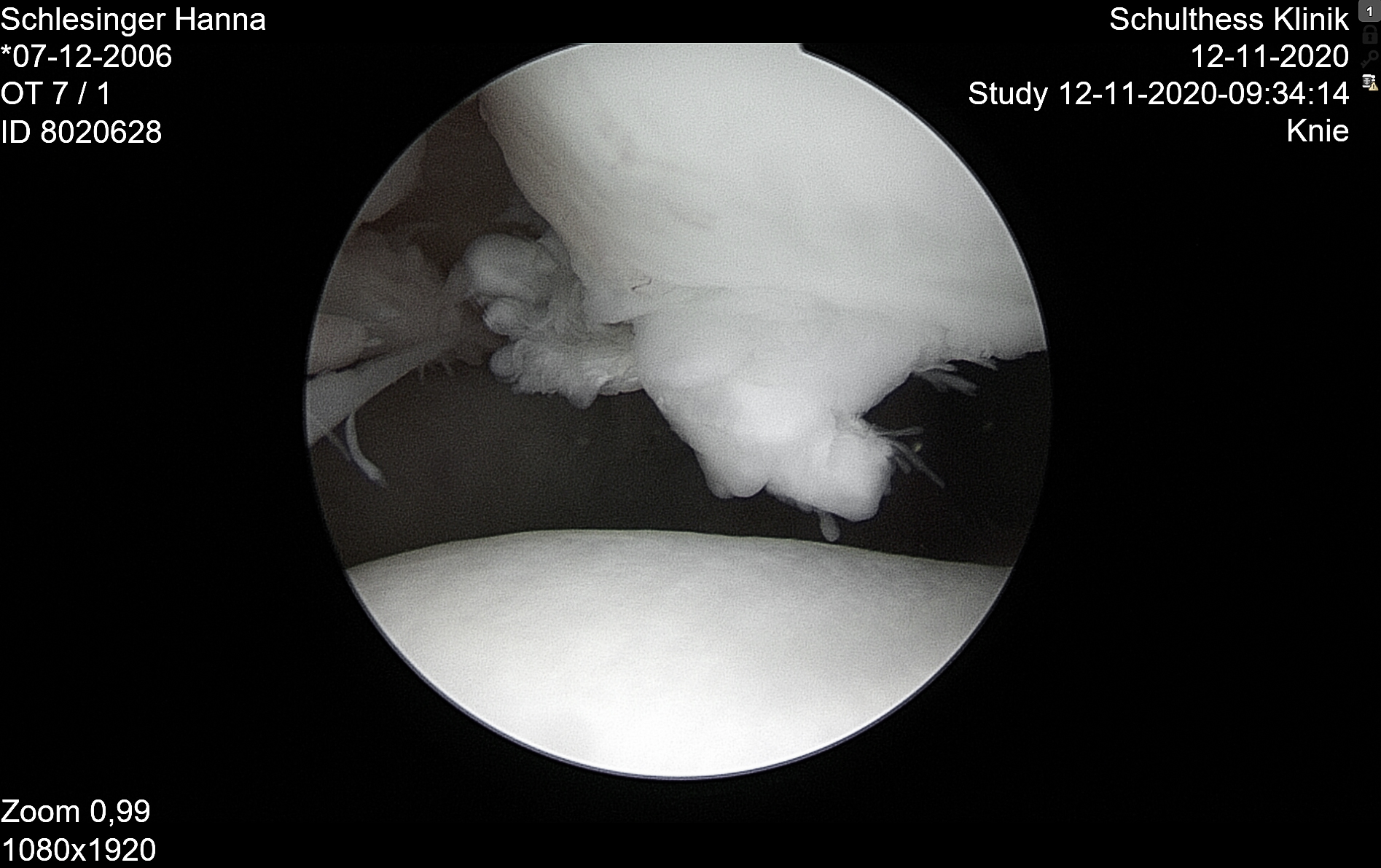

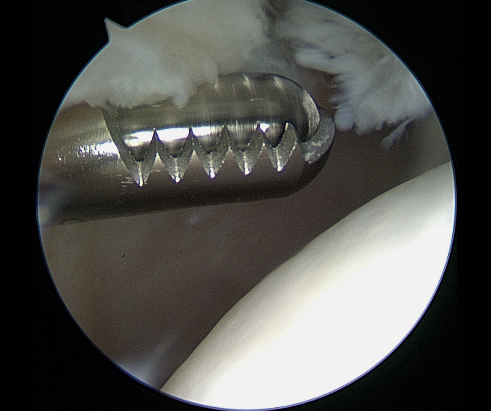

Patella bipartita
Zweigeteilte Patellae sehen wir in der kinderorthopädischen Praxis häufig als asymptomatischen Zufallsbefund. Normalerweise verknöchern mehrfach angelegte Ossifikationskerne der Patella spontan, aber auch bei Persistenz sind diese nicht unbedingt als pathologisch zu werten. Beschwerden treten erst auf, wenn es zwischen den Knochenkernen zu einer traumatischen oder chronischen Lockerung kommt. Typische Lokalisation des zusätzlichen Ossifikationszentrums
ist der superolaterale Patellapol, seltener der laterale Patellarand.
Beschwerden und Befunde
Die Patienten klagen über belastungsabhänge, mitunter stechende Schmerzen am superolateralen Patellapol. Meist ist es im Vorfeld zu einer direkten oder überlastungsbedingten Traumatisierung gekommen. Die Verdachtsdiagnose kann
klinisch gestellt werden, beweisend ist das Röntgenbild (Abb. 31).
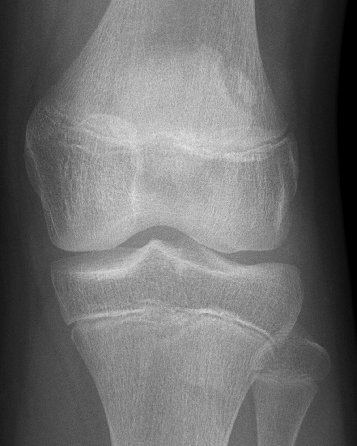

Gegenüber einer Patellafraktur kann die Patella bipartita in der Regel durch die weich begrenzte Kontur und die typische Lokalisation und Form gut abgegrenzt werden.
Behandlung
Die Behandlung ist in der Regel konservativ mit beschwerdeadaptierter Schonung und Sportkarenz, unterstützt durch analgetische Massnahmen. Bei Beschwerdepersistenz weitere Diagnostik mittels MRI. Zeigt sich das Fragment stark instabil, wird
eine operative Therapie evaluiert. Typische kleine superolaterale Fragmente dürfen problemlos entfernt werden, grössere, welche relevante Gelenkflächen für die Patella darstellen, werden angefrischt und verschraubt.


