Einleitung
Am Universitäts-Kinderspital Zürich existiert seit 2009 eine interdisziplinäre dermatologisch-rheumatologische Sprechstunde. Während zu Beginn lediglich einzelne Patienten und Patientinnen gemeinsam beurteilt wurden, findet sie aufgrund der positiven Erfahrungen und des zunehmenden Bedarfs zwischenzeitlich in regelmässigem Rhythmus statt.
Die Patienten und Patientinnen werden einerseits von externen Kollegen und Kolleginnen bei interdisziplinären Fragestellungen direkt zugewiesen. Andererseits stammen die Kinder aus der internen dermatologischen respektive rheumatologischen Sprechstunde, sowie von vielen anderen Disziplinen wie der allgemeinen Pädiatrie, der Gastroenterologie oder auch der interdisziplinären Notfallstation.
Das Spektrum der in diesem Rahmen behandelten Krankheitsbilder ist breit und umfasst alle Formen der entzündlichen Bindegewebserkrankungen, Vaskulitiden, die unterschiedlichen Typen der juvenilen idiopathischen Arthritis mit begleitenden kutanen Symptomen und vasookklusive Erkrankungen, um nur einige Beispiele zu nennen.
Im Laufe der Zeit sind zudem neue Krankheitsbilder hinzugekommen wie beispielsweise durch COVID-19 hervorgerufene Manifestationen an Gelenken und Haut. Daneben wurde in den letzten Jahren auch für Kinder eine Vielzahl neuer immunmodulatorischer Medikamente zugelassen, welche ganz neue Behandlungsmöglichkeiten eröffnen. Damit einhergehend sind zunehmend spezifisch auf das Kindesalter fokussierte Studiendaten verfügbar, was zur Entwicklung von internationalen Therapiestandards auch in dieser Patientengruppe geführt hat.
Von der interdisziplinären Sprechstunde profitieren in erster Linie die Patienten und Patientinnen, da sie gleichzeitig die Expertise beider Fachdisziplinen in Anspruch nehmen können. Abklärungen, Beratung und Therapie erfolgen entsprechend koordiniert, was Doppelspurigkeiten und unnötige Termine vermeidet. Auch ist eine kontinuierliche Betreuung mit gleichbleibenden Ansprechpartnern gewährleistet.
Umgekehrt ermöglicht dieses Gefäss auch ein gegenseitiges sowie gemeinsames Lernen. Der jeweils andere Hintergrund erweitert den eigenen Horizont und trägt damit massgeblich zu einer Steigerung der Behandlungsqualität bei.
In der Folge möchten wir anhand von drei klinischen Beispielen Einblick in unsere klinische Tätigkeit geben.
Dermatologische Nebenwirkung bei rheumatologischer Therapie
Fallbeschreibung 1: In der rheumatologischen Sprechstunde stellte sich eine 10-jährige Patientin aufgrund jahrelanger Schmerzen im Bereich des rechten Sprunggelenkes vor. Mittels MRI und weiterer Diagnostik wurde die Diagnose einer chronisch rekurrierenden, multifokalen Osteomyelitis (CRMO) gestellt mit ausgedehntem Befall der distalen
Tibiametaphyse und des Os naviculare rechts. Zudem bestanden Signalalterationen auch in der proximalen Tibia links. Bei Persistenz der Beschwerden und einer Zunahme der ossären Manifestationen im MRI unter NSAR wurde die Behandlung gemäss aktueller Behandlungsempfehlungen auf Adalimumab umgestellt 1.
Schon drei Monate nach Therapiestart war die Patientin im Alltag absolut beschwerdefrei und konnte wieder uneingeschränkt ihren sportlichen Aktivitäten nachgehen.
Allerdings traten nach weiteren fünf Monaten Behandlung erythematöse, teils exsudative, krustige, juckende bis schmerzhafte Plaques im Bereich des Skalps auf (Abb. 1a und b). Vereinzelt bestanden auch erythematosquam.se Plaques an anderer Lokalisation und ein Befall einzelner N.gel (Abb. 1c und d). Es erfolgte eine dermatologische Mitbeurteilung und aufgrund des Kontexts und der charakteristischen klinischen Pr.sentation wurde die Diagnose einer paradoxen psoriasiformen Reaktion unter TNF-alpha-Inhibition gestellt 2–4. Eigen- wie Familienanamnese waren hinsichtlich Psoriasis bland.
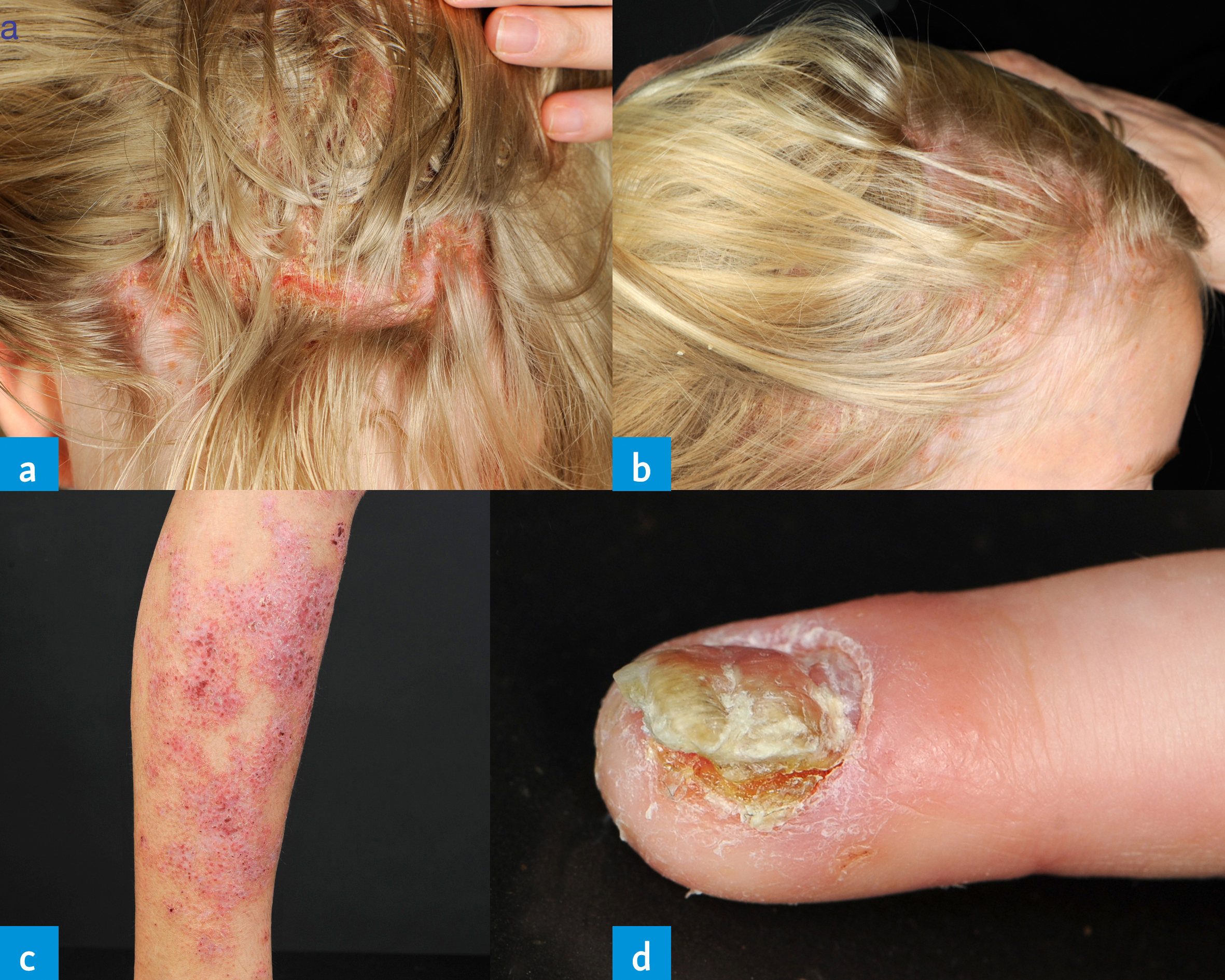
Unter prolongierter Behandlung mit potenten topischen Steroiden und Vitamin-D-Analoga konnten die Hautmanifestationen so weit kontrolliert werden, dass eine Fortsetzung des TNF-Blockers möglich war.
Diskussion: Das Auftreten paradoxaler psoriasiformer Reaktionen unter TNF-Blockern (paradox, da die TNF-Inhibitoren sehr erfolgreich zur Therapie der Psoriasis eingesetzt werden) ist bei Erwachsenen wie Kindern gut bekannt und betrifft deren Einsatz in allen Bereichen, namentlich der Dermatologie, Rheumatologie und Gastroenterologie 2, 3. Pathogenetisch dürfte eine dysregulierte Typ-I-Interferonantwort unter TNF-Inhibition zugrunde liegen 3.
Das Risiko des Auftretens psoriasiformer Manifestationen scheint abhängig zu sein vom eingesetzten TNF-Blocker und der behandelten Erkrankung. Über alle TNF-Blocker und Erkrankungen gesehen, beträgt das Risiko 3–5 % 2, 3, 5. Unter Infliximab dürften etwa 8%, unter Adalimumab 3–4% und unter Etanercept 1% betroffen sein 2. Mehrere Arbeiten weisen zudem darauf hin, dass Patienten und Patientinnen mit chronisch-entzündlichen Darmerkrankungen, namentlich M. Crohn, am h.ufigsten betroffen sind 4, 5.
In unserem Kollektiv an pädiatrischen Patienten und Patientinnen mit CRMO entwickelten um die 50% paradoxale psoriasiforme Reaktionen. Ob diese Beobachtung einer zufälligen Häufung entspricht, ist schwierig zu beurteilen. Die limitierte Literatur legt für CRMO-Patienten und Patientinnen mit bis zu 18 % eine deutlich höhere Inzidenz paradoxer psoriasiformer Reaktionen als bei anderen Grunderkrankungen nahe 6–8. Es bleibt jedoch zu erwähnen, dass das Hintergrundrisiko für Psoriasis bei CRMO bereits ohne TNF-Inhibitor deutlich erh.ht ist 9.
Die paradoxen psoriasiformen Manifestationen unter TNF-Blockade sind oftmals durch einen ausgeprägten und prädominanten Skalpbefall gekennzeichnet mit Ausbildung einer Alopezie. Auch die palmoplantare Haut ist häufig betroffen, nicht selten mit Ausbildung von Pusteln 2–4.
Die Behandlung der Hautmanifestationen ist abhängig von Schweregrad und Lokalisation (vgl. Tabelle)2, 8.
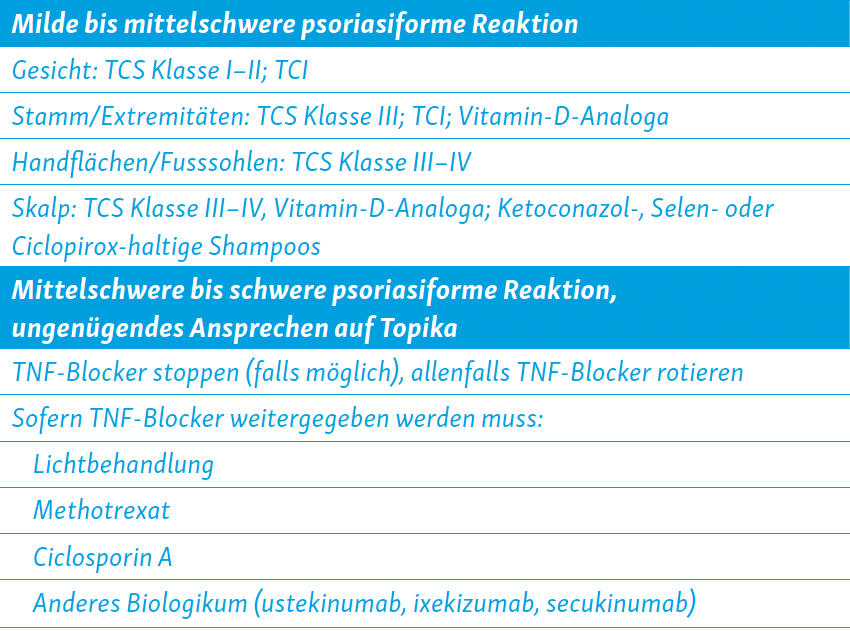
Milde bis mittelschwere psoriasiforme Läsionen können oft mittels Topika wie potenten Kortikosteroiden, Vitamin-D-Analoga und Calcineurininhibitoren kontrolliert werden. Bei schwererem Hautbefall soll nach Möglichkeit der TNF-Blocker gestoppt (oder gewechselt) werden. Ist dies nicht möglich oder kommt es nicht zu einer Resolution nach Beendigung der Behandlung, können eine Phototherapie oder weitere Immunmodulatoren wie Methotrexat, Ciclosporin A, Ustekinumab oder IL-17-Blocker eingesetzt werden 2, 8.
Wir mussten bei zwei von uns behandelten Kindern mit CRMO den TNF-Blocker stoppen, die anderen liessen sich wie im Patientenbeispiel mit Topika ausreichend behandeln.
Rheumatologische Nebenwirkung bei dermatologischer Therapie
Fallbeschreibung 2: Ein 14-jähriger, aus Griechenland stammender Patient stellte sich notfallmässig bei seit 2 Wochen rasch progredienten, immobilisierenden Rückenschmerzen tieflumbal und sakral vor. Die klinische Untersuchung war vereinbar mit einer Sakroileitis. Der übrige Gelenkstatus sowie die klinische Untersuchung waren unauffällig, laborchemisch zeigten sich leicht erhöhte Entzündungsparameter, HLA-B27 war negativ.
In der Systemanamnese bestanden abgesehen von einer ausgeprägten Akne vulgaris, welche seit 2 Monaten mit Isotretinoin behandelt wurde und darunter aufflammte, keine Auffälligkeiten (Abb. 2).

Auch die Familienanamnese war unauffällig, insbesondere ohne Hinweise auf eine Psoriasis oder Spondarthropathien.
Im MRI bestätigte sich eine beidseitige Sakroiliitis, zudem bestand eine Enthesitis mit Ostitis an den Deckplatten von LWK 2 und 3 ohne Zeichen einer Osteomyelitis, so dass die Diagnose einer enthesitis-assoziierten juvenilen idiopathischen Arthritis gestellt wurde (Abb. 3).
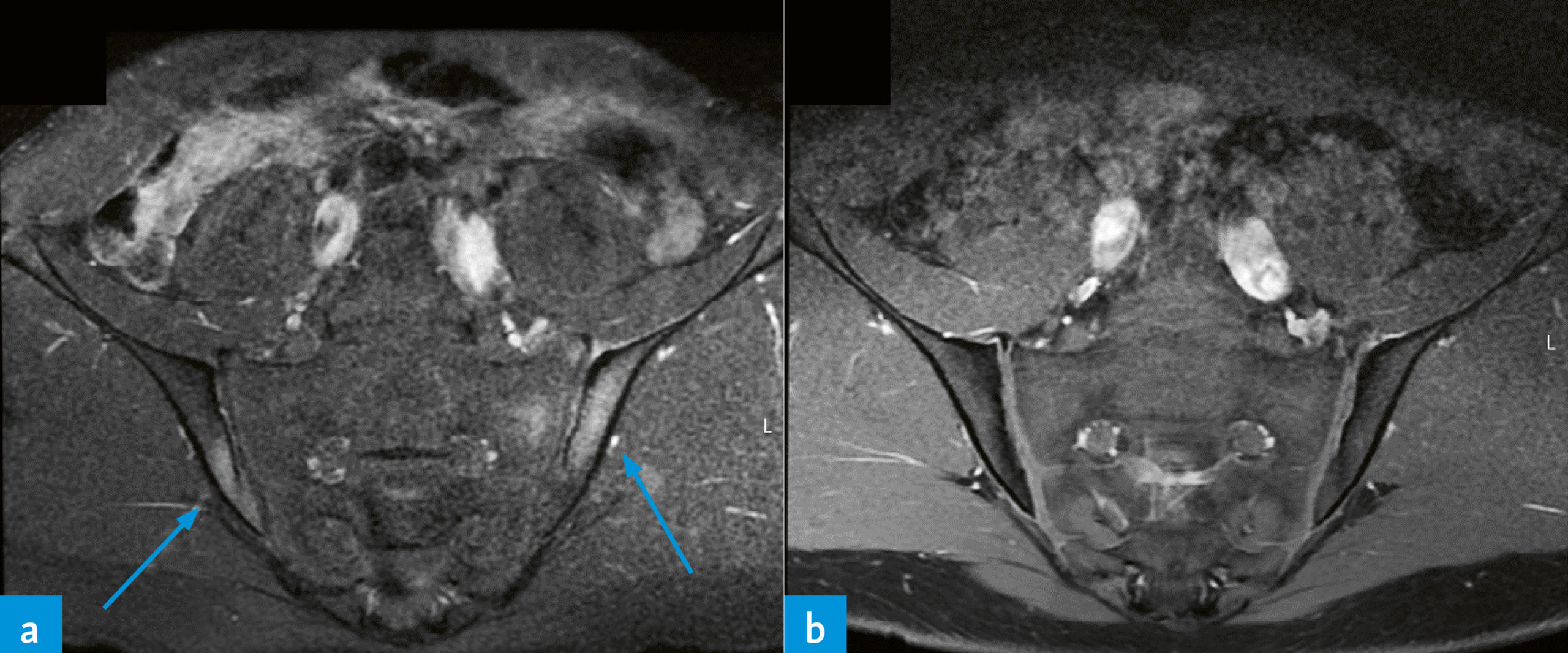
In den differentialdiagnostischen .Überlegungen wurde in Anbetracht der schweren Akne vulgaris an ein SAPHO-Syndrom gedacht. Auch andere mit pustulösen Hautmanifestationen assoziierte Erkrankungen wie monogenetische autoinflammatorische Syndrome (DIRA, DITRA, PAPA, PAPASH) wurden in Betracht gezogen, schienen aber weniger passend. Als Arbeitshypothese im Vordergrund stand jedoch aufgrund des zeitlichen Zusammenhangs eine durch Isotretinoin induzierte Sakroiliitis.
Isotretinoin wurde sofort gestoppt und eine Behandlung mit einem NSAR begonnen. Aufgrund der exazerbierten Akne wurde parallel mit Spiricort für 2 Wochen und Dapson begonnen. Unter diesen Massnahmen kam es innert weniger Tage zu einer deutlichen Besserung der rheumatologischen Symptomatik. Das NSAR konnte nach 8 Wochen gestoppt werden und die Befunde zeigten sich im Verlaufs-MRI nach 3 Monaten normalisiert. Das Dapson wurde bei ausgeheilter Akne vulgaris nach 9 Monaten ebenfalls gestoppt und der Patient ist seit nunmehr 2 Jahren ohne Behandlung symptomfrei.
Diskussion: Isotretinoin stellt seit Jahrzehnten die Therapie der Wahl für schwere Formen der Akne vulgaris dar. Systemische Retinoide können mit Nebenwirkungen am Bewegungsapparat assoziiert sein. Diese umfassen Myalgien und Arthralgien, Verkalkungen von Sehnen und Bändern, sowie in Abhängigkeit von Dosis und Therapiedauer auch Hyperostosen an der Wirbels.ule (DISH-like) und vorzeitigen Epiphysenschluss 10. In den letzten Jahren haben sich zudem Berichte zu Beschwerden der unteren Wirbelsäule bei bis zur Hälfte der mit Isotretinoin behandelten PatientInnen gehäuft 11, 12. Während diese oftmals mechanischer Natur sind, scheinen entzündliche Veränderungen im Sinne einer Sakroiliitis und anderer Spondarthropathie-assoziierter Manifestationen über mehrere Publikationen hinweg konsistent bei ca. 10% der mit Isotretinoin behandelten Jugendlichen aufzutreten, wobei ein Grossteil der PatientInnen HLA-B27 negativ ist 10–15. Die meisten dieser Berichte stammen aus dem Nahen Osten, so dass die hohe Inzidenz möglicherweise auf Kofaktoren zurückzuführen ist. Kürzlich haben wir aber auch eine Schweizer Patientin mit ausgeprägter Sakroiliitis unter Isotretinoin behandelt, so dass bei allen PatientInnen mit entsprechender Symptomatik unter Isotretinoin an diese Zusammenhänge zu denken ist.
Therapie der Wahl ist ein sofortiger Stopp von Isotretinoin und Beginn mit einem NSAR, worunter die meisten Betroffenen rasch beschwerdefrei werden. In Einzelfällen waren Methotrexat oder ein TNF-alpha-Blocker erforderlich 15.
Lokalisierte Sklerodermie (Morphea) – auf die frühere Therapie kommt es an
Fallbeschreibung 3: Die Patientin wurde zugewiesen aufgrund einer rasch progredienten Verdickung und Sklerose der Haut im Bereich der Wange rechts über die vergangenen zwei Monate (Abb. 4a und c). Anamnestisch hatte der Prozess bereits 6 Monate davor begonnen mit einer hellen Makula, zudem wurde eine zunehmende Anhebung des rechten Mundwinkels beobachtet.
Im Rahmen der klinischen Untersuchung wurde eine vergleichbare, lineäre Läsion auch im Bereich der rechten Schulter inklusive Oberarm ersichtlich (Abb. 4e). Zudem war eine Verhärtung des Tractus iliotibialis am Oberschenkel rechts ohne Oberflächenveränderung, aber mit geringerem Umfang im Vergleich zu links, augenfällig.
Der rheumatologische Status ergab eine eingeschränkte Extension des rechten Ellbogens, des rechten Knies und des rechten OSG. Das Kiefergelenk war, soweit beurteilbar, uneingeschränkt.
Die Diagnose einer ausgedehnten, rasch progredienten, lineären lokalisierten Sklerodermie (Morphea) wurde gestellt. Im Schädel-MRI fanden sich keine Hinweise auf eine Kiefergelenksarthritis und keine Hinweise auf intrazerebrale Manifestationen einer zirkumskripten Sklerodermie 16. Allerdings wurde bei deutlicher Unterkieferasymmetrie zur Beobachtung des Kieferwachstums eine kieferorthopädische Anbindung bei einem für Kiefergelenksarthritis spezialisierten Kollegen initiiert.
Eine Therapie mit i. v.-Methylprednisolonpulsen, oralen Steroiden und Methotrexat s.c. wurde initiiert 17. Zudem wurde mit Physiotherapie gestartet.
Unter der etablierten Therapie kam es nur zu einem ungenügenden Ansprechen, weswegen nach 3 Monaten zusätzlich mit Abatacept i. v. gestartet wurde 18. In der Folge zeigte sich ein sehr gutes Therapieansprechen mit praktisch vollständiger Regredienz der kutanen Sklerose (Abb. 4b und d). Die orale Steroidtherapie wurde nach 8 Monaten, Abatacept nach 12 Monaten beendet und mit Methotrexat alleine fortgefahren.

Im Rahmen der regelmässigen interdisziplin.ren Kontrollen fiel im Verlauf eine Beinlängendifferenz zu Ungunsten des betroffenen Beins auf, was bei der lineären zirkumskripten Sklerodermie gut bekannt ist. Zusätzlich zeigten sich eine leicht zunehmende Einsenkung im Bereich der Stirn und ein neues, kleines alopezisches Areal parietal rechts als Zeichen einer neuen Aktivierung der Erkrankung, weswegen nach 1,5 Jahren Pause wieder mit Abatacept i. v. begonnen werden musste. Kurz darauf musste das Methotrexat bei massiver Übelkeit gestoppt und mit Abatacept alleine fortgefahren werden.
Unter Physiotherapie kam es zu einer deutlichen Besserung der Beweglichkeit v.a. im Ellbogen- und Kniegelenk. Das Sprunggelenk zeigte weiter leichte Einschränkungen in der Flexion/Extension, was die Patientin aber im Alltag nicht einschränkte.
Nach knapp 2 Jahren Monotherapie und stabilen Befunden erfolgte ein neuerlicher Therapiestopp. Allerdings bestanden schon nach 4 Monaten in der ambulanten Verlaufskontrolle erneute Aktivitätszeichen, so dass Abatacept wiederum gestartet werden musste.
Diskussion: Die lokalisierte Sklerodermie oder Morphea ist eine entzündliche Erkrankung der Haut und des subkutanen Fettgewebes, die zu einer Verhärtung dieser Strukturen durch Kollagenvermehrung und im Verlauf zu einer Atrophie führt. Je nach Subtyp können tiefere Strukturen wie Muskeln, Gelenke und Knochen mitbefallen sein 16, 19. Die Morphea ist die häufigste Form der Sklerodermie im Kindesalter und von der systemischen Sklerose klar abzugrenzen 19, 20. Übergänge werden nicht beobachtet.
Die Pathogenese der lokalisierten Sklerodermie ist bis heute nicht gänzlich geklärt. Es wird von einer genetischen Disposition ausgegangen 21. Wie bei vielen Autoimmunerkrankungen wurden zudem verschiedene Auslöser beschrieben, die als Trigger der Erstmanifestation in Frage kamen 21. Bisher konnte allerdings kein eindeutiger kausaler Zusammenhang nachgewiesen werden. Insbesondere gilt dies auch für die früher oft berichtete Induktion durch eine stattgehabte Infektion mit Borrelien.
Die Inzidenz der lokalisierten Sklerodermie im Kindesalter beträgt 3,4/1 000 000 22. Dieses seltene Auftreten führt gemeinsam mit dem schleichenden, initial oft unspezifischen Beginn häufig zu einer verzögerten Zuweisung und Diagnosestellung 23. Ein ungünstiges Outcome mit irreversiblen Residuen ist die Folge einer verspäteten Therapieeinleitung. Zudem zeigen spät diagnostizierte und behandelte Patienten und Patientinnen auch eine höhere Rückfallrate 24.
Ein grosses Problem stellt die Einschätzung der entzündlichen Aktivität der Erkrankung dar. Bis heute gibt es keine validierten Parameter, die diese sicher darstellen können. Weder eine Biopsie noch Laborparameter oder das MRI können die Entzündungsaktivität zuverlässig einschätzen 17, 25. Vor allem klinische Verlaufsuntersuchungen und eine gute Fotodokumentation können bei der Einschätzung der Aktivität hilfreich sein.
Es werden verschiedene Formen der lokalisierten Sklerodermie unterschieden, wobei im Kindesalter mit Abstand am häufigsten die lineäre Form auftritt 19, 26, 27. Sie tritt meist unilateral am Kopf («en coup de sabre» – Säbelhieb) oder an den Extremitäten auf. Oftmals sind bei dieser Manifestation auch die darunter liegenden Muskeln und Knochen und infolgedessen Gelenke betroffen, was zu Bewegungseinschränkungen und/oder zu Wachstumsstörungen an der betroffenen Lokalisation führen kann 16, 28. Bei Läsionen am Kopf können auch ZNS-Manifestationen wie lokalisierte Atrophien, Verkalkungen bis hin zur ZNS-Vaskulitis auftreten. Entsprechend ist bei Befall des Kopfes ein Schädel-MRI als Baseline-Untersuchung indiziert 17, 27. Aufgrund des gehäuften Auftretens von Uveitiden sollten insbesondere in den ersten Jahren der Erkrankung regelmässige ophthalmologische Kontrollen erfolgen 17.
Ziel der Therapie ist, das Fortschreiten des entzündlichen Prozesses zu stoppen und weitere Komplikationen zu vermeiden. Entgegen früheren Annahmen zeigen sklerosierte Areale unter antientzündlicher Therapie durchaus das Potential zur Regredienz 29. Therapie der Wahl für alle Formen der aktiven lineären lokalisierten Sklerodermie ist eine Kombinationstherapie mit systemischen Steroiden und Methotrexat 17, 27, 29–31. Als klassische second-line Behandlung bei Methotrexat-Unverträglichkeit oder ungenügendem Ansprechen gilt Mycophenolat-Mofetil 32–34.
Zunehmend erscheinen Berichte zum erfolgreichen Einsatz von Abatacept bei therapierefrakt.ren oder rasch progredienten Formen der lokalisierten Sklerodermie im Kindesalter 18, 35. Auch in unserer Erfahrung bewährt sich dieses Medikament sehr und wird von uns zunehmend grosszügig in dieser Indikation eingesetzt.
Hinsichtlich Dauer der antientzündlichen Systemtherapie existiert kein Konsens. Sicherlich sollten 1–2 Jahre keine Hinweise auf Aktivität vorliegen, bevor die Therapie gestoppt wird. Aufgrund des hohen Rezidivrisikos von mind. 25% (auch nach Jahren!) sind regelmässige Verlaufskontrollen nach Therapieende zwingend indiziert 36.
Schlussfolgerungen und Ausblick
Wir hoffen, mit diesen Ausführungen und Beispielen den Wert und Nutzen einer interdisziplinären, pädiatrischen dermatologisch-rheumatologischen Sprechstunde aufgezeigt zu haben. Wir sind überzeugt, dass dieses Angebot einen Mehrwert schafft und betroffenen Kindern eine raschere Beurteilung, diagnostische Einordnung und Therapie und damit ein besseres Outcome ermöglicht.
Insbesondere im Hinblick auf die neuen, in naher Zukunft zur Verfügung stehenden Systemtherapien ist der interdisziplinäre Austausch und das Teilen von Erfahrungen zwischen unterschiedlichen Spezialist* innen wichtig. Dies gilt umso mehr für die pädiatrische Altersgruppe, wo klinische Studien oftmals verzögert durchgeführt werden und somit neue Medikamente häufig über lange Zeit off-label eingesetzt werden müssen.
Referenzen
- Koryllou A, Mejbri M, Theodoropoulou K, Hofer M, Carlomagno R. Chronic nonbacterial osteomyelitis in children. Children. 2021 Jul 1;8(7)
- Cyrenne BM, Parpia AS, Sibbald C. Paradoxical psoriasis in pediatric patients: A systematic review. Pediatr Dermatol. 2021;(June):1086–93
- Conrad C, di Domizio J, Mylonas A, Belkhodja C, Demaria O, Navarini AA, et al. TNF blockade induces a dysregulated type i interferon response without autoimmunity in paradoxical psoriasis. Nat Commun. 2018 Dec 1;9(1)
- Brown G, Wang E, Leon A, Huynh M, Wehner M, Matro R, et al. Tumor necrosis factor-α inhibitor-induced psoriasis: Systematic review of clinical features, histopathological findings, and management experience. Vol. 76, Journal of the American Academy of Dermatology. Mosby Inc.; 2017. p. 334–41
- Bataille P, Layese R, Claudepierre P, Paris N, Dubiel J, Amiot A, et al. Paradoxical reactions and biologic agents: a French cohort study of 9303 patients*. British Journal of Dermatology. 2022 Nov 1;187(5):676–83
- Kodama S, Gupta D, Sullivan E, Rosenwasser N, Zhao Y. Paradoxical psoriasis after exposure to tumour necrosis factor inhibitors in children: a retrospective cohort study. Vol. 186, British Journal of Dermatology. John Wiley and Sons Inc; 2022. p. 1043–5
- Campbell JA, Kodama SS, Gupta D, Zhao Y. Case series of psoriasis associated with tumor necrosis factor-α inhibitors in children with chronic recurrent multifocal osteomyelitis. JAAD Case Rep. 2018 Sep 1;4(8):767–71
- Rosenwasser N, Lee D, Sidbury R, Zhao Y. Paradoxical Psoriasis in Children Receiving Anti-TNFα Treatment for Inflammatory/autoimmune Disease. Vol. 23, Pediatric Drugs. Adis; 2021. p. 131–41
- Buckley LH, Xiao R, Perman MJ, Grossman AB, Weiss PF. Psoriasis Associated With Tumor Necrosis Factor Inhibitors in Children With Inflammatory Diseases. Arthritis Care Res (Hoboken). 2021 Feb 1;73(2):215–20
- Karaosmanoğlu N, Mülkoğlu C. Analysis of musculoskeletal side effects of oral Isotretinoin treatment: A cross-sectional study. BMC Musculoskelet Disord. 2020;21(1):1–10
- Baykal Selçuk L, Aksu Arıca D, Baykal Şahin H, Yaylı S, Bahadır S. The prevalence of sacroiliitis in patients with acne vulgaris using isotretinoin. Cutan Ocul Toxicol. 2017;36(2):176–9
- Elnady B, Elkhouly T, Dawoud NM, Desouky DE, Kewan HH, Dawoud DM, et al. New onset of axial spondyloarthropathy in patients treated with isotretinoin for acne vulgaris: incidence, follow-up, and MRI findings. Clin Rheumatol. 2020
- Alkan S, Kayiran N, Zengin O, Kalem A, Kimyon G, Kilinc EO, et al. Isotretinoin-induced spondyloarthropathy-related symptoms: A prospective study. Journal of Rheumatology. 2015;42(11):2106–9
- Yilmaz Tasdelen O, Yurdakul FG, Duran S, Bodur H. Isotretinoin-induced arthritis mimicking both rheumatoid arthritis and axial spondyloarthritis. Int J Rheum Dis. 2015;18(4):466–9
- Karadağ ŞG, Sönmez HE, Tanatar A, Çakan M, Aktay Ayaz N. Isotretinoin-induced sacroiliitis: Case series of four patients and a systematic review of the literature. Pediatr Dermatol. 2020;37(1):171–5
- Zulian F, Vallongo C, Woo P, Russo R, Ruperto N, Harper J, et al. Localized scleroderma in childhood is not just a skin disease. Arthritis Rheum. 2005 Sep;52(9):2873–81
- Constantin T, Foeldvari I, Pain CE, Pálinkás A, Höger P, Moll M, et al. Development of minimum standards of care for juvenile localized scleroderma. Vol. 177, European Journal of Pediatrics. Springer Verlag; 2018. p. 961–77
- Li SC, Torok KS, Ishaq SS, Buckley M, Edelheit B, Ede KC, et al. Preliminary evidence on abatacept safety and efficacy in refractory juvenile localized scleroderma. Rheumatology (Oxford). 2021 Aug 2;60(8):3817–25
- Weibel L. Diagnosis and management of morphoea in children: an overview. Vol. 46, Clinical and Experimental Dermatology. Blackwell Publishing Ltd; 2021. p. 487–94
- Foeldvari I, Culpo R, Sperotto F, Anton J, Avcin T, Baildam E, et al. Consensus-based recommendations for the management of juvenile systemic sclerosis. Rheumatology (United Kingdom). 2021 Apr 1;60(4):1651–8
- Torok KS, Li SC, Jacobe HM, Taber SF, Stevens AM, Zulian F, et al. Immunopathogenesis of pediatric localized scleroderma. Vol. 10, Frontiers in Immunology. Frontiers Media S.A.; 2019
- Herrick AL, Ennis H, Bhushan M, Silman AJ, Baildam EM. Incidence of childhood linear scleroderma and systemic sclerosis in the UK and Ireland. Arthritis Care Res (Hoboken). 2010;62(2):213–8
- Weibel L, Laguda B, Atherton D, Harper JI. Misdiagnosis and delay in referral of children with localized scleroderma. Vol. 165, British Journal of Dermatology. Blackwell Publishing Ltd; 2011. p. 1308–13
- Martini G, Fadanelli G, Agazzi A, Vittadello F, Meneghel A, Zulian F. Disease course and long-term outcome of juvenile localized scleroderma: Experience from a single pediatric rheumatology Centre and literature review. Vol. 17, Autoimmunity Reviews. Elsevier B.V.; 2018. p. 727–34
- Lis-Święty A, Janicka I, Skrzypek-Salamon A, Brzezińska-Wcisło L. A systematic review of tools for determining activity of localized scleroderma in paediatric and adult patients. Vol. 31, Journal of the European Academy of Dermatology and Venereology. Blackwell Publishing Ltd; 2017. p. 30–7
- Peterson L, Nelson A, Su W. Classification of morphea (localized scleroderma). May Clinic proceedings. 1995;70(11):1068–76
- Zulian F, Culpo R, Sperotto F, Anton J, Avcin T, Baildam EM, et al. Consensus-based recommendations for the management of juvenile localised scleroderma. Ann Rheum Dis. 2019 Mar 2;annrheumdis-2018-214697
- Zulian F, Athreya BH, Laxer R, Nelson AM, Feitosa de Oliveira SK, Punaro MG, et al. Juvenile localized scleroderma: Clinical and epidemiological features in 750 children. An international study. Rheumatology. 2006 May;45(5):614–20
- Weibel L, Theiler M, Howell KJ, Denton CP, Waelchli R, Atherton D, et al. Prospective evaluation of treatment response and disease reversibility of paediatric localized scleroderma (morphoea) to steroids and methotrexate using multi-modal imaging. Journal of the European Academy of Dermatology and Venereology. 2020;34(7):1609–16
- Li SC, Torok KS, Pope E, Dedeoglu F, Hong S, Jacobe HT, et al. Development of consensus treatment plans for juvenile localized scleroderma: A roadmap toward comparative effectiveness studies in juvenile localized scleroderma. Arthritis Care Res (Hoboken). 2012 Aug;64(8):1175–85
- Weibel L, Sampaio MC, Visentin MT, Howell KJ, Woo P, Harper JI. Evaluation of methotrexate and corticosteroids for the treatment of localized scleroderma (morphoea) in children. British Journal of Dermatology. 2006 Nov;155(5):1013–20
- Martini G, Ramanan A v., Falcini F, Girschick H, Goldsmith DP, Zulian F. Successful treatment of severe or methotrexate-resistant juvenile localized scleroderma with mycophenolate mofetil. Rheumatology (Oxford). 2009;48(11):1410–3
- Arthur M, Fett NM, Latour E, Jacobe H, Kunzler E, Florez-Pollack S, et al. Evaluation of the Effectiveness and Tolerability of Mycophenolate Mofetil and Mycophenolic Acid for the Treatment of Morphea. JAMA Dermatol. 2020;156(5):521–8
- Martini G, Saggioro L, Culpo R, Vittadello F, Meneghel A, Zulian F. Mycophenolate mofetil for methotrexate-resistant juvenile localized scleroderma. Rheumatology (United Kingdom). 2021 Mar 1;60(3):1387–91
- Wehner Fage S, Arvesen KB, Olesen AB. Abatacept improves skin-score and reduces lesions in patients with localized scleroderma: A case series. Vol. 98, Acta Dermato-Venereologica. Medical Journals/Acta D-V; 2018. p. 465–6
- Mertens JS, Seyger MMB, Kievit W, Hoppenreijs EPAH, Jansen TLTA, van de Kerkhof PCM, et al. Disease recurrence in localized scleroderma: A retrospective analysis of 344 patients with paediatric- or adult-onset disease. British Journal of Dermatology. 2015 Mar 1;172(3):722–8

