Einteilung (Übersicht)
Die Einteilung des Schmerzes kann nach verschiedenen Kriterien erfolgen. Von grosser therapeutischer Bedeutung sind die Klassifizierungen nach der Pathogenese sowie nach der Zeitdauer.
Zeit
Grundsätzlich muss unterschieden werden zwischen dem akuten Schmerz mit seiner eindeutigen Warn- und Schutzfunktion sowie dem chronischen Schmerz, der seinen Bezug zum auslösenden Ereignis verloren hat und zur eigenständigen Krankheit geworden ist.
Akuter Schmerz
Die Warn- und Schutzfunktion des akuten Schmerzes dient der körperlichen Unversehrtheit bzw. Funktionsfähigkeit. Akute Schmerzen haben die Aufgabe, Schädigungen aufzuzeigen und durch Einleiten von Ausweichreaktionen vor weiteren Schäden zu bewahren. Postoperative Schmerzen werden ebenfalls den akuten Schmerzen zugeordnet.
Aufgrund seiner eindeutigen Warnfunktion sowie der normalerweise absehbaren Schmerzdauer (Nachlassen des Schmerzes nach Ende der Schädigung oder Abheilen) wird der akute Schmerz von den Patienten in der Regel akzeptiert und bis zu einem gewissen Grad toleriert. Akuter Schmerz sollte frühzeitig und angemessen behandelt werden, um eine chronische Schmerzentwicklung zu vermeiden.
Chronischer Schmerz
Chronische Schmerzen dagegen dauern über den üblichen Verlauf der akuten Erkrankung oder der zu erwartenden Heilungszeit an. Sie haben ihre Ursache sowie Schutzfunktion verloren. Für den Patienten stellen sie eine nicht zu unterschätzende Beeinträchtigung dar, für den behandelnden Arzt eine besondere therapeutische Herausforderung.
Auch immer wiederkehrende Schmerzen wie z.B. Migräne gelten als chronische Schmerzen, wenn sie an mehr als 15 Tagen im Monat auftreten.
Werden chronische Schmerzen nicht adäquat behandelt, kommt es zu einer langen Leidensphase der betroffenen Patienten und oftmals zu weitreichenden zusätzlichen Komplikationen. Die Patienten zeigen häufig eine zunehmende körperliche Inaktivität mit folgender sozialer Isolation.
Sie können eine dysphorische Stimmung bis hin zur Depression entwickeln, ihr Selbstwertgefühl ist stark beeinträchtigt. Chronische Schmerzen können zur physischen, psychischen und sozialen Zermürbung des Patienten führen.
Schmerzarten und pathophysiologische Grundlagen
Schmerzen lassen sich nach ihrer Ätiologie (bzw. nach pathogenetischen Kriterien) in Nozizeptorschmerz, neuropathischen Schmerz und durch psychologische Mechanismen (mit-) bedingte Schmerzen einteilen. Bei klinischen Schmerzsyndromen wie z.B. Tumorschmerz sind häufig mehrere pathogenetische Mechanismen beteiligt («Mixed Pain»).
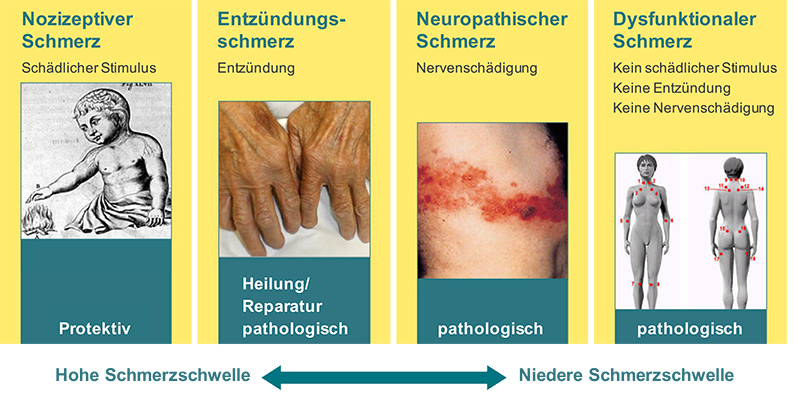
Nozizeptorschmerzen
Der Nozizeptorschmerz ist der «Prototyp» des akuten Schmerzes. Durch eine Gewebeschädigung kommt es zur direkten Erregung der Schmerzrezeptoren. Je nach Entstehungsort werden somatische und viszerale Schmerzen unterschieden.
Die somatischen Schmerzen werden nochmals unterteilt in einen oberflächlichen Schmerz aus Haut oder Schleimhaut sowie einen tiefen Schmerz, der von Muskulatur, Knochen oder Gelenken ausgeht. Der tiefe somatische Schmerz besitzt einen eher dumpfen Charakter, während der oberflächliche Schmerz aus einer frühen hellen und einer späteren dumpfen Komponente besteht.
Der viszerale oder Eingeweideschmerz ist dumpf und schlecht lokalisierbar, wird öfters von vegetativen Reaktionen begleitet und kann in korrespondierende Head-Zonen im Bereich der Haut ausstrahlen («übertragener Schmerz»).
Nozizeptive, entzündungsbedingte Schmerzen
Neben den Schmerzreizen, die von aussen auf den Körper einwirken, können auch körpereigene Schmerzmediatoren mit den Rezeptoren reagieren und damit Schmerzen auslösen. Häufig ist dies bei Entzündungen der Fall.
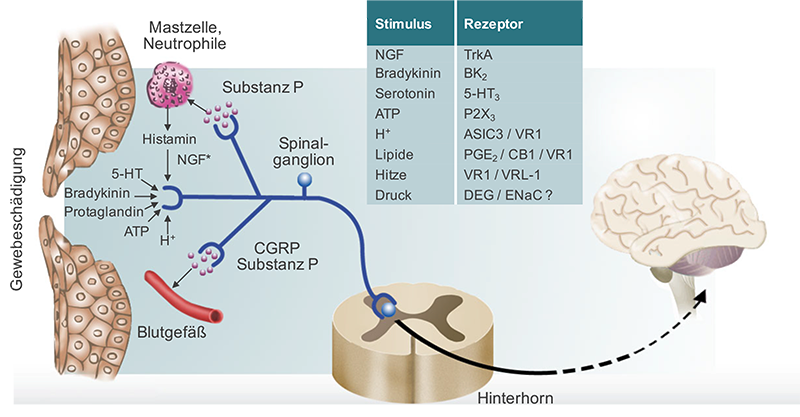
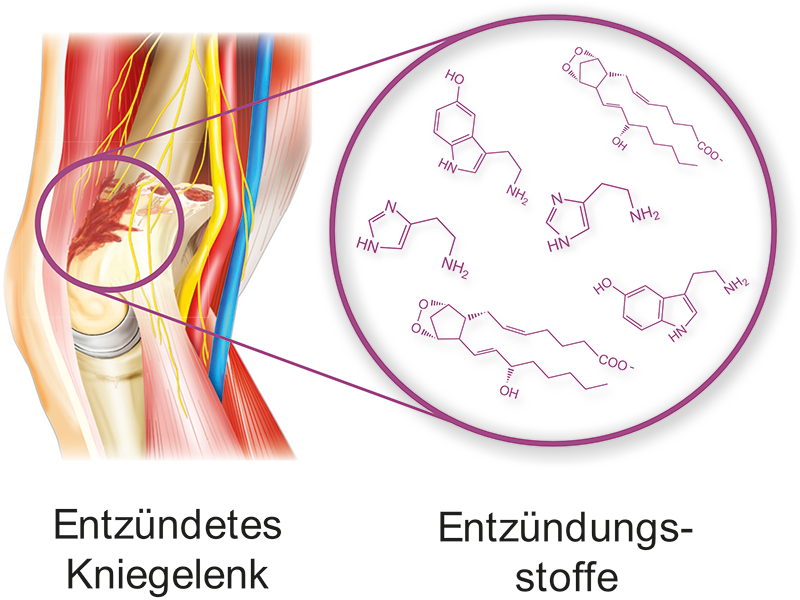
Die endogenen Entzündungsmediatoren werden nach entsprechendem Reiz freigesetzt oder synthetisiert und sind pathophysiologisch an der Entstehung einer Entzündung beteiligt. Die Entzündungsmediatoren führen zur direkten Erregung von Nozizeptoren (Spontanschmerzen im Bereich des Entzündungsgebiet) bzw. zur Sensibilisierung, d.h. zu einer Schwellensenkung von Nozizeptoren (Dauerschmerzen bei chronisch entzündlichen Erkrankungen). Quelle der Entzündungsmediatoren sind verletzte Gewebszellen (ATP, K+, Enzyme, Prostaglandine, H+ u.a.), Blut und Plasma (Bradykinin), Thrombozyten (Serotonin), Mastzellen (Histamin, Nervenwachstumsfaktor NGF u.a.) sowie Leukozyten (Zytokine, Prostaglandine, Leukotriene u.a.).
Diese Art entzündlicher Nozizeptorschmerzen findet man beispielsweise bei der rheumatoide Arthritis.
Neuropathische Schmerzen
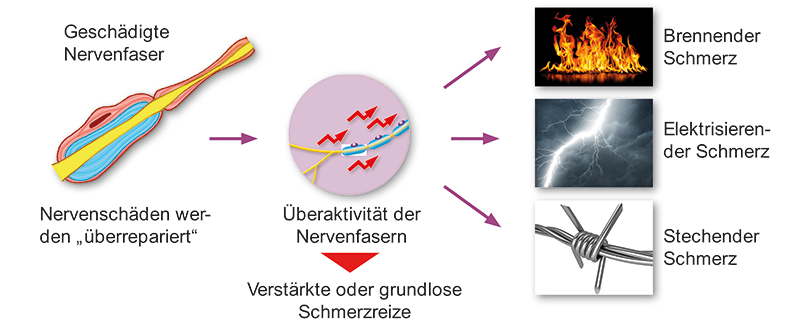
Bei neuropathischen Schmerzen liegt eine Schädigung der Nervenfasern zugrunde. Der Schmerz wird häufig in das Versorgungsgebiet der Nerven projiziert («projizierter Schmerz»). Neuropathische Schmerzen können aus einer Reihe von Krankheiten oder Verletzungen entstehen. Dabei kann die primäre Schädigung jede Ebene des schmerzverarbeitenden Systems betreffen, z.B. das periphere Nervensystem, Hirnnerven, Spinalwurzeln, das Rückenmark oder Gehirn.
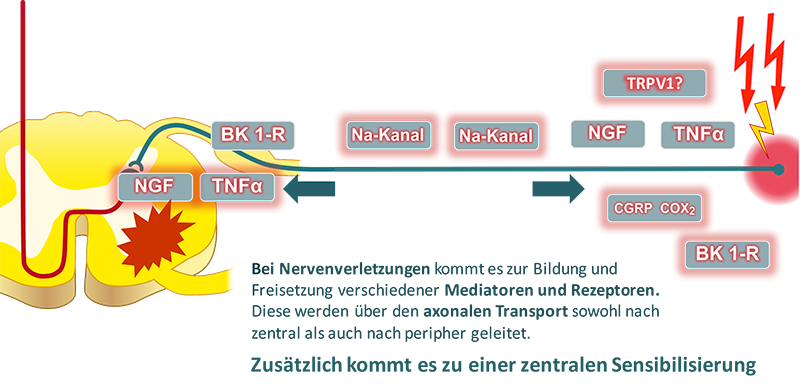
Bei Nervenverletzungen kommt es zur Bildung und Freisetzung von Mediatoren (TNF? und Rezeptoren. Diese Rezeptoren werden über den axionalen Transport zum Spinalganglion transportiert. Daraufhin werden im Spinalganglion neue Rezeptoren (BK1), Kanäle (Na, Ca) und Enzyme (COX-2) gebildet und in die Peripherie beziehungsweise ins Zentralnervensystem geleitet. Die Folgen sind spontane Reizbildungen im Nerv, eine stärkerer Empfindlichkeit in der Peripherie und eine Sensibilisierung im Rückenmark. Folge sind häufig auch neurologische «plus» und «minus» Begleitsymptome.
Betroffene beschreiben neuropathische Schmerzen meist als einschiessend, elektrisierend, brennend und kribbelnd.
Dysfunktionale Schmerzen
Dysfunktionale Schmerzen sind dadurch gekennzeichnet, dass die Körpereigene Schmerzhemmung nicht (mehr) ausreichend funktioniert.
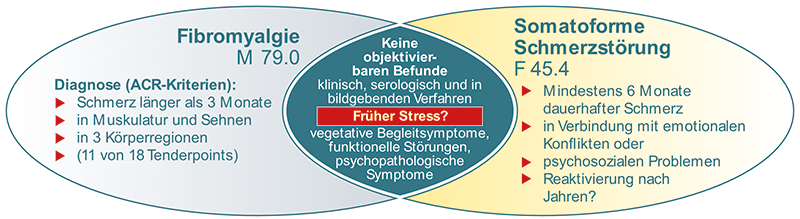
Diese Art von Schmerzen werden häufig bei psychosozialer Belastung in der Biographie gesehen (Gewalterfahrung, Verlusterlebins etc.). Zu dieser Schmerzart zählen etwa somatoforme Schmerzstörungen sowie die Fibromyalgie. Rein durch psychologische Mechanismen verursachte Schmerzen werden in ihrer Häufigkeit jedoch oftmals überschätzt, tatsächlich sind sie eher selten. Häufig sehen wir chronische Schmerzen mit körperlichen und psychischen Faktoren.
Gemischter Schmerz (Mixed-Pain)
Vom gemischte Schmerzen spricht man dann wenn mehrere Pathophysiologische Ursachen beteiligt sind ( nozizeptive, nozizeptiv- entzündliche und/oder neuropathische bzw. dysfunktional). Eine effektive Schmerztherapie berücksichtigt daher die verschiedenen Komponenten.
Insbesondere bei Rückenschmerzerkrankungen und Tumorschmerzen tritt die gemischte Schmerzform häufig (Mixed Pain) auf.
Auch bei anderen Schmerzerkrankungen wie der Arthrose können sowohl nozizeptive als auch neuropathische Anteile beteiligt sein.
Chronifizerungsprozesse
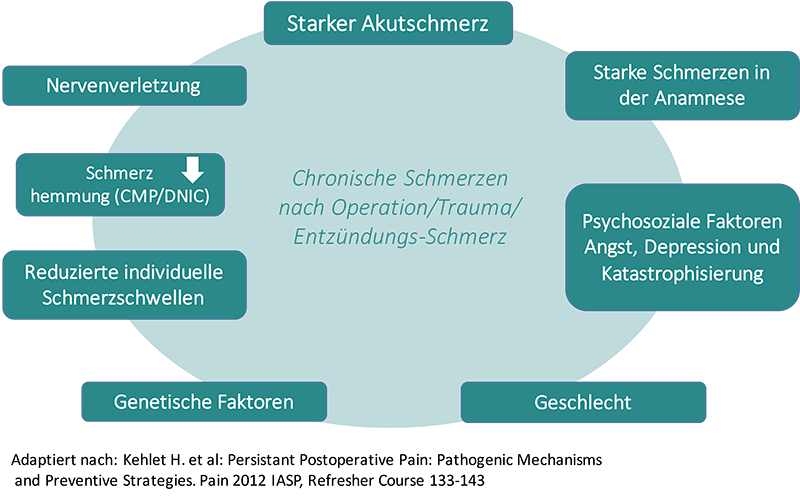
Zentrale Punkte im Chronifizierungsprozess sind die periphere und zentrale Sensibilisierung. Die periphere und zentrale Sensibilisierung sind verantwortlich für das Entstehen von Allodynie und Hyperalgesie.
Neben diesen pathophysiologischen Vorgängen spielen aber auch genetische, psychische, soziale und so genannte iatrogene Faktoren eine Rolle.
Ursachen der Chronifizierung nach Operation/Trauma/Entzündungs-Schmerz
Peripher Sensibilisierung im Detail
Bei pathophysiologischen Veränderungen, wie beispielsweise einer Entzündung, kommt es zur Herabsetzung der Reizschwelle der Nozizeptoren, zuvor funktionell inaktive C-Fasern («schlafende Neurone») werden geweckt und entfalten spontane und evozierte Aktivität.
Ingesamt führen diese Vorgänge zu einer pathologisch gesteigerten Erregungsleitung im ersten afferenten Neuron.
Die klinische Konsequenz besteht in erheblichem, die Zeit des Traumas lange überdauerndem Spontanschmerz, sowie in einer gesteigerten Empfindlichkeit auf schmerzhafte Reize im Bereich des Traumas (primäre Hyperalgesie).
Mechanismus der peripheren Sensibiliserung
In der Haut befinden sich zahlreiche Nozizeptoren. Für die Sensibilisierung sind C-Fasern von besonderer Bedeutung. Die Nervenfasern reagieren auf schädigende Einflüsse mit einem Aktionspotential.
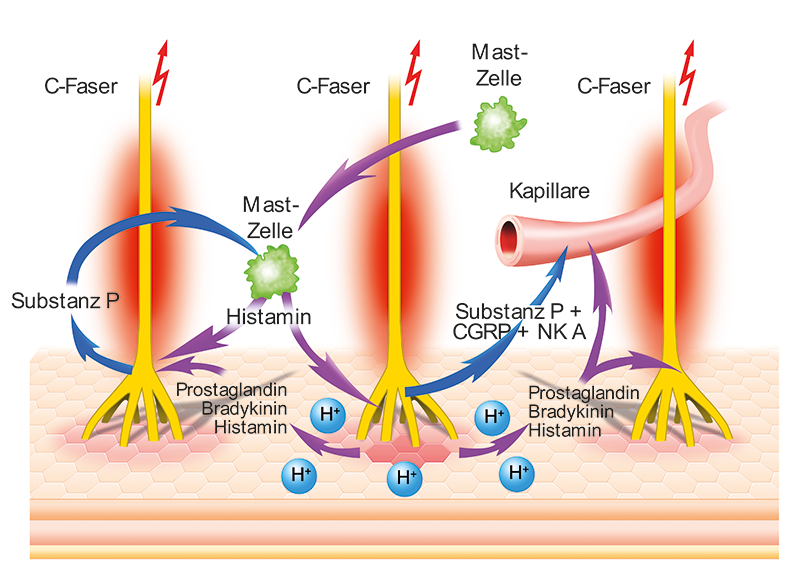
Neben der direkten Aktivierung der Nozizeptoren kommt es auch zu einer entzündlichen Reaktion des betroffenen Gewebes: Durch die pH-Absenkung, Prostaglandinsynthese und Ausschüttung von Bradykinin, Histamin und anderen Mediatoren werden weitere Nozizeptoren, sogenannte schlafende Nozizeptoren «geweckt» und/oder direkt gereizt.
Die Mediatoren (v. a. Prostaglandine, Bradykinin und Histamin) bewirken ausserdem eine Kapillardilatation und erhöhen die Gefässpermeabilität. Vor allem Prostaglandine sensibilisieren die Schmerzrezeptoren und erhöhen deren Reaktion auf nozizeptive Reize.
Die afferenten C-Fasern reagieren auf den gesteigerten nozizeptiven Input mit der peripheren Ausschüttung von Substanz P, CGRP und Neurokinin A. Substanz P und CGRP (Calcitonin Gene-Related Peptide) sind starke Vasodilatatoren. Substanz P führt ausserdem zu einer Erhöhung der Kapillarpermeabilität, Stimulation immun-kompetenter Zellen und Mastzelldegranulation. Die Mastzellmediatoren (v.a. Histamin) verstärken die Vasodilatation und Plasmaextravasation. Diese Vorgänge werden auch als neurogene Entzündung bezeichnet.
Zentral Sensibilisierung im Detail
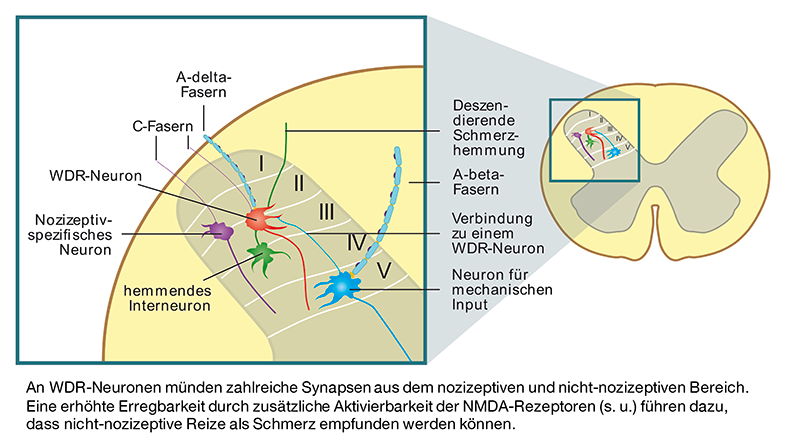
Bei anhaltenden Schmerzreizen kommt es zu einer zentralen Sensibilisierung. Hierbei handelt es sich um ein Zusammenwirken verschiedener Mechanismen. Anscheinend spielen jedoch die Aktivierung von NMDA-Rezeptoren und die damit einhergehenden plastischen Veränderungen der zentralen Neurone eine wesentliche Rolle. Die genannten Sensisibilisierungsvorgänge führen zu einer Zunahme der Spontanaktivität sowie zu stärkeren Reizantworten der zentralen Neurone.
Die spinale Sensibiliserung ist gekennzeichnet durch die sekundäre Hyperalgesie, d.h. eine vermehrte Schmerzempfindlichkeit in dem die Schädigung umgebenden, nicht betroffenen Gewebe.
Ein nozizeptiver Einstrom führt zur Freisetzung von exzitatorischen Neurotransmittern wie Glutamat, Substanz P, Neurokinin A oder Calcitonin Gene-Related Peptide, die an Rezeptoren der Hinterhornzelle binden und dadurch ein Aktionspotential auslösen, das zum Gehirn fortgeleitet wird.
Dabei scheint Glutamat der wichtigste Überträgerstoff im Rückenmark zu sein. Glutamat bindet an verschiedene Rezeptoren, den metabotroben Glutamat-Rezeptor, NMDA- und non- NMDA-Rezeptoren. Der für die Sensibilisierung besonders bedeutende NMDA-Rezeptor ist normalerweise durch Mg++-Ionen blockiert, so dass Glutamat physiologischerweise nicht zu einer Aktivierung des NMDA-Rezeptors führt. Bei wiederholten Schmerzreizen kommt es zu einer Aktivierung der NMDA-Rezeptoren (durch Aufhebung des Mg 2+ -Blocks). Diese lösen dann langdauernde postsynaptische Potentiale aus, die als Schmerzreize weitergeleitet werden. Die Aktivierung von NMDA-Rezeptoren gilt als hauptverantwortlich für die Entstehung des zentralen «wind-up».
Die anhaltende, starke Erregung der Hinterhornzelle führt zu strukturellen Veränderungen.
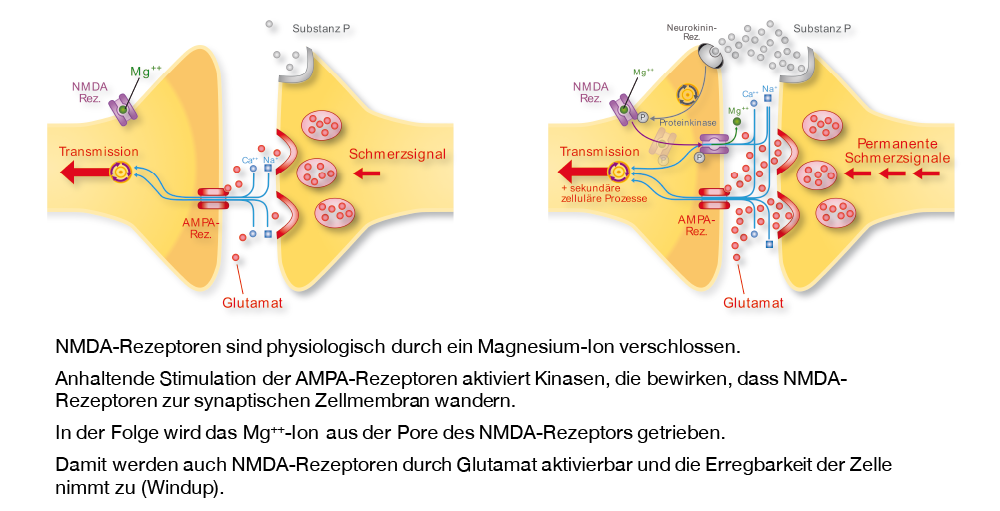
Die Aktivierung der NMDA-Rezeptoren sowie auch weiterer Neuropeptid-Rezeptoren führt zu einer Erhöhung der intrazellulären Ca++- Konzentration. Diese ist mitverantwortlich für die Exprimierung von immediate early genes (z. B. c-fos und c-jun), die wiederum zu einer gesteigerten Proteinsynthese führt. Aufgrund der damit verbundenen Erhöhung der Rezeptorendichte wird auch die neuronale Empfindlichkeit (Chemosensitivität) gesteigert.
Gedächtnis / Schmerzmatrix Detail
Die Reizverarbeitung im Gehirn erfolgt in einem hierarchisch gegliederten System. Die höher stehenden Areale bilden dabei Netzwerke, so dass beispielsweise ein Schmerzreiz mehrere Gebiete, die Schmerzmatrix, aktiviert. Das Gehirn ist auch äusserst plastisch, es verändert sich ständig. Repetitive Reize führen über diese neuronale Plastizität zu Veränderungen, die auch nach Verschwinden des Reizes weiter bestehen und wie zum Beispiel bei chronischen Schmerzen so das Schmerzempfinden aufrechterhalten.
Melzack und Wall haben bereits 1968 die zentrale Verarbeitung des Schmerzes untersucht.1 Das Erleben von Schmerz führt nach ihrer Ansicht zu einer Aktivierung sensorisch-diskriminativer Komponenten (Lokalisation und Identifikation). Sehr rasch werden zudem affektiv-motivationale und kognitive Komponenten aktiviert sowie eine vegetative Reaktion ausgelöst. Bei einem nozizeptiven Reiz wird primär eine motorische Fluchtreaktion ausgelöst. Bei einem chronischen Reiz entwickelt sich aus dieser Fluchtreaktion eine über das Motoneuronensystem laufende, generalisierte Gesamttonisierung. Dadurch entstehen die uns bekannten Verspannungs- zustände bei chronischen Schmerzen. Das Netzwerk der Areale, die bei Schmerz aktiviert werden, wird als Schmerzmatrix bezeichnet. Diese Matrix ist integrativ im Gehirn vorhanden, d.h. die im Netzwerk aktivierten Areale bestehen alle bereits. Das Netzwerk kann zudem auch chronisch aktiviert bleiben. Eine chronische Aktivierung der Matrix führt zu einem erhöhten Energieverbrauch und in der Folge zu einer Unterversorgung der anderen Netzwerke. Darum kommt es bei chronischen Schmerzen auch zu einer Bradyphrenie – einer Verlangsamung der geistigen Funktionen – und zu Problemen mit der Stimmung. Beim Patienten mit chronischen Schmerzen genügt eine schlechte Stimmung, um einen nozizeptiven Schmerz zu verstärken. Umgekehrt kann eine Verbesserung der Stimmungslage, z.B. im Rahmen psychotherapeutischer Massnahmen, dazu beitragen, dass der Schmerz gedämpft wird. Daher sind multimodale Ansätze zur Behandlung von chronischen Schmerzen auch sinnvoll und wichtig.
Aktuellere Arbeiten haben zudem gezeigt, dass die beiden nahe beieinander liegenden Netzwerke für Schmerz und Belohnung miteinander interagieren.2
Weder das Schmerz- noch das Belohnungssystem können zwischen verschiedenen Qualitäten und Ätiologien einer Stimulation unterscheiden. So wird das Schmerzsystem bei physischen Schmerzen gleich stark aktiviert wie bei sozialen Schmerzen (z.B. Mobbing, sozialer Ausschluss). Die stärkste Stimulation des Belohnungssystems erfolgt nicht durch die Freude, wie man sie zum Beispiel beim Beschenken anderer empfindet, sondern durch Schadenfreude.3
Schmerzmodulation
(Deszendierende Hemmung etc.)
Schmerzmodulation
Das Zentralnervensystem kann die Schmerzempfindung modulieren, d.h. verstärken oder hemmen (Schmerzmodulation). Im Zusammenhang mit der Schmerztherapie liegt das Augenmerk auf der hemmenden Komponente der Modulation, welche durch vom Grosshirn ins Rückenmark absteigende Bahnen vermittelt wird. Diese kann medikamentös und nicht-medikamentös verstärkt werden.
Absteigende Schmerzhemmung
Die absteigende Hemmung ist ein körpereigener Abwehrmechanismus gegenüber Schmerzen:
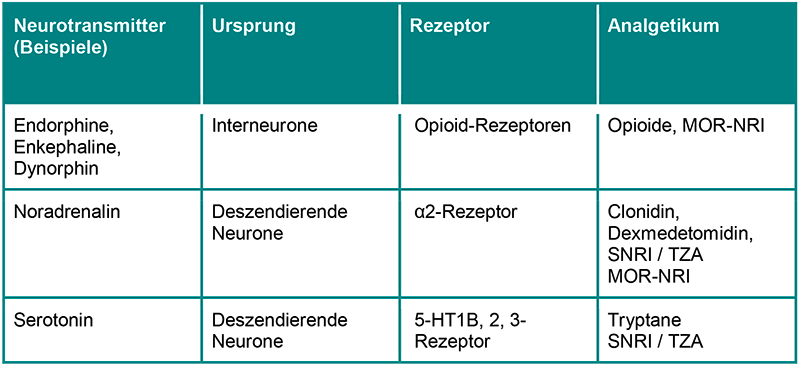
Im Gehirn werden über absteigende Bahnen Hemmmechanismen aktiviert, die zur Schmerzmodulation auf der Ebene der Wirbelsäule führen. Serotonin und Noradrenalin, die vom Hirnstamm produziert werden, wirken auch auf die hemmenden Bahnen des Rückenmarks. Beide Transmitter werden nach ihrer Freisetzung durch eine Wiederaufnahme aus dem extrazellulären Raum entfernt. Während Serotonin sowohl schmerzhemmend (inhibitorisch) als auch schmerzverstärkend (exitatorisch) wirken kann, führt die spinale Ausschüttung von Noradrenalin ausschliesslich zu einer selektiven Schmerzhemmung.
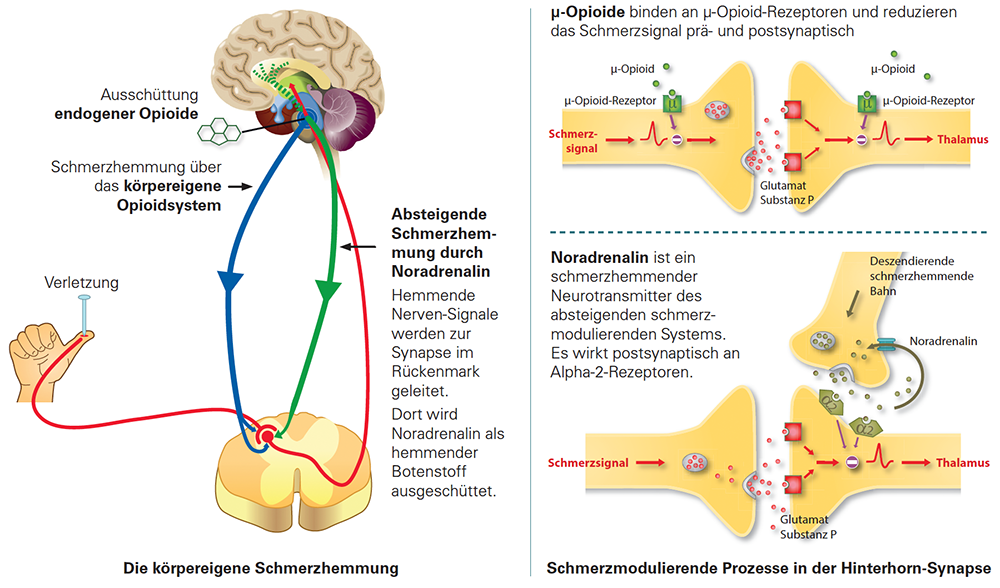
Während eines akuten schmerzhaften Ereignisses werden Endorphine aus spinalen und supraspinalen Interneuronen freigesetzt. Sie binden an prä- und postsynaptische Opioidrezeptoren. Präsynaptisch reduziert die Aktivierung von Opioidrezeptoren die Freisetzung von erregenden Neurotransmittern; postsynaptisch verstärkt sie die Hyperpolarisierung der Membran durch einen verstärkten K-Ausstrom.
Die spezifischen Wirkorte für hemmende Transmitter sind auch Ziele pharmakologischer Interventionen:
Referenzen
- Melzack R, Wall PD. Sensory motivational and central control determinants of pain. In: Kenshalo DR (ed) The skin senses. Thomas, Springfield, 1968, 423-439.
- Lieberman MD, Eisenberger NI. Neuroscience. Pains and pleasures of social life. Science 2009;323:890-1.
- Takahashi H et al. When your gain is my pain and your pain is my gain: neural correlates of envy and schadenfreude. Science 2009;323:937-9.