Die axiale Spondyloarthritis im Rampenlicht – Teil 2
13. November 2023
Erfahren Sie im Interview mit Prof. Dr. med Denis Poddubnyy, Leiter der Rheumatolgie der Charité Berlin, mehr über die Wirksamkeit und Sicherheit von Upadacitinib bei ankylosierender Spondylitis anhand aktueller Daten.
Video-Dauer: 3:55 Minuten
Pour les sous-titres français, veuillez cliquer sur le symbole «cc».
Mit freundlicher Unterstützung von:



Die axiale Spondyloarthritis im Rampenlicht – Teil 1
6. November 2023
Im Interview mit Prof. Dr. med. Denis Poddubnyy, Leiter der Rheumatolgie der Charité Berlin, beleuchten wir in einer zweiteiligen Video-Serie die folgenden Themen:
- Im heutigen ersten Teil erkunden wir die einzigartigen Merkmale von Patient:innen mit axialer Spondyloarthritis und decken mögliche signifikante Unterschiede auf.
- Im zweiten Teil nächste Woche werfen wir einen Blick auf die Wirksamkeit und Sicherheit von Upadacitinib bei ankylosierender Spondylitis anhand aktueller Daten
Video-Dauer: 6:14 Minuten
Pour les sous-titres français, veuillez cliquer sur le symbole «cc».
Mit freundlicher Unterstützung von:



Screening von SSc-Patienten auf PAH – die letzten Empfehlungen
23. Oktober 2023
Video-Dauer: 6:08 Minuten
Pour les sous-titres français, veuillez cliquer sur le symbole «cc».
Mit freundlicher Unterstützung von:






Neue EULAR-Empfehlungen zu ANCA-assoziierter Vaskulitis
4. September 2023
Video-Dauer: 6:15 Minuten
Pour les sous-titres français, veuillez cliquer sur le symbole «cc».
Mit freundlicher Unterstützung von:






Vidéo des temps forts du symposium Pfizer SSR
8 septembre 2022
Les intervenant·e·s, le Prof. Thomas Hügle, le Dr Elena Nikiphorou, le Dr
Michael Andor et Christine Pfrimmer ont discuté des recommandations EULAR
2021 concernant les stratégies d’autogestion pour les patient·e·s et l’utilisation
de solutions de santé numériques en rhumatologie – comme par exemple les
applications pour patient·e·s Sidekick, mySCQM ou RheumaBuddy – dans
le cadre du symposium «The role of digital healthcare solutions in selfmanagement
strategies for patients with RA#».1
Tous les points forts ont été résumés pour vous dans une vidéo.
Durée de la vidéo: 14:30 minutes
#This event is a promotional symposium funded and initiated by Pfizer.
Références:
- Nikiphorou E, Santos EJF, Marques A, et al 2021 EULAR recommendations for the implementation of selfmanagement strategies in patients with inflammatory arthritis. Annals of the Rheumatic Diseases 2021;80:1278-1285.
Référence disponibles sur demande.
Avec l’aimable soutien de:

PP-UNP-CHE-0387 OKT 2022
Krankheitsmodifikation beim systemischen Lupus erythematodes (SLE)
19. September 2022
Video-Dauer: 6:07 Minuten
Randomised controlled trials versus real-world evidence
Aufgrund der neutralen und informativen Darstellung des Themas stellt Rheuma Schweiz dieses Video zur Verfügung.
Video-Dauer: 7:45 Minuten
Mit freundlicher Unterstützung von:

Axiale Psoriasis-Arthritis (axPsA) und axiale Spondyloarthritis (axSpA): Dasselbe oder doch ganz anders?
11. April 2022
Pour les sous-titres français, veuillez cliquer sur 

Video-Dauer: 4:49 Minuten
Secukinumab versus Adalimumab bei Psoriasis-Arthritis (PsA)
Einleitung
Die therapeutischen Optionen der systemisch anwendbaren Medikamente für die Psoriasis und die Psoriasis-Arthritis haben sich ausserordentlich entwickelt. Neben Methotrexat und Salazopyrin wurden sie um Leflunomid, anti-TNF-, IL-12/23- und IL-17A-Antikörper, PDE4-Hemmer und JAK-Inhibitoren erweitert.
Nach der rheumatoiden Arthritis stellt sich auch für die Psoriasis-Arthritis die Frage nach dem direkten Vergleich der Wirksamkeit von Biologika verschiedener Wirkmechanismen, und von JAK-Inhibitoren, in randomisierten, doppelblinden Studien. Eine Antwort auf diese Frage kann die Entscheidung für ein Therapeutikum nach Versagen oder Unverträglichkeit eines konventionellen Basistherapeutikums leiten. In der EXCEED Studie wurde nun der direkte Vergleich von Secukinumab versus Adalimumab im Hinblick auf einen Gelenkspezifischen Endpunkt in der PsA untersucht.
Publikation
McInnes et al[1] haben kürzlich die Ergebnisse einer randomisierten, doppelblind kontrollierten Studie im Lancet präsentiert, in der die Wirksamkeit und Sicherheit von Secukinumab, einem anti-IL-17A-Antikörper, gegen jene des Adalimumab, einem anti-TNF-Antikörper verglichen wurde. Secukinumab und Adalimumab wurden als Monotherapie bei Fällen mit Psoriasis-Arthritis mit ≥ 3 geschwollenen und ≥ 3 druckempfindlichen Gelenken eingesetzt. Für den Einschluss mussten eine aktive Plaque-Psoriasis oder dokumentierte frühere Plaque-Psoriasis, bzw. für Psoriasis typische Nagelveränderungen vorhanden sein. Frühere Behandlungen mit konventionellen Basistherapeutika waren erlaubt, aber nicht eine Kombination während der Studie; die Teilnehmenden waren Biologika-naiv.
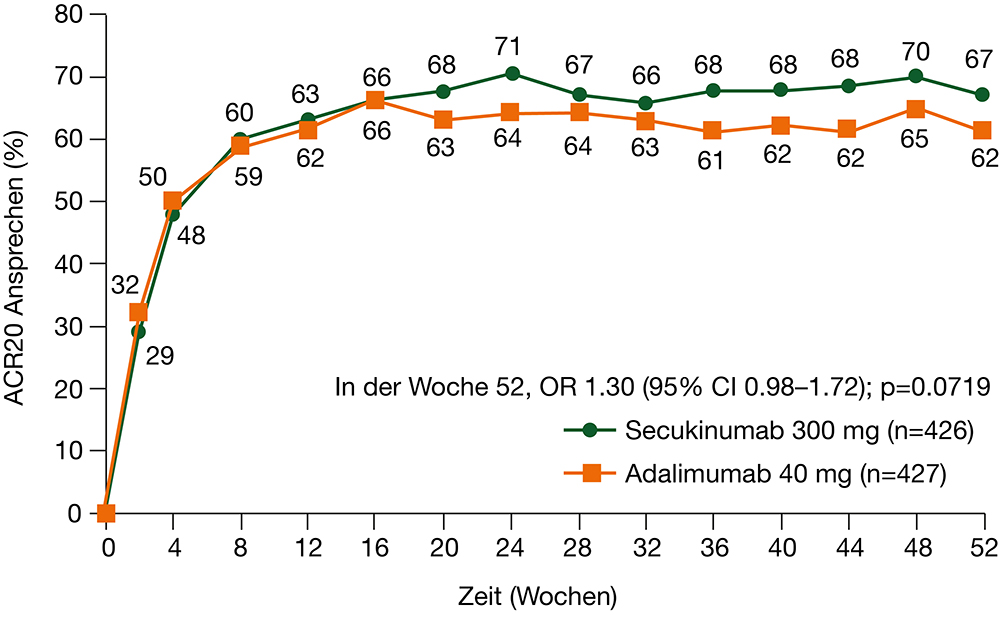
Nach Randomisierung standen für die Secukinumab-Gruppe 426 und für die Adalimumab-Gruppe 427 Fälle zur Verfügung, von denen ein hoher Anteil von 371, respektive 338, die Studie bis Woche 52 abschlossen. Secukinumab wurde in der Dosis von 300 mg s.c. nach Aufdosierung alle 4 Wochen und Adalimumab 40 mg s.c. alle 2 Wochen angewendet.
Der primäre Endpunkt war die Überlegenheit des Secukinumab gegenüber Adalimumab für das Verhältnis der Patientinnen und Patienten mit mindestens 20%-iger Besserung der ACR Ansprech-Kriterien (ACR20) bei Woche 52. Bei vergleichbaren demographischen Parametern und Ausgangswerten für Aktivität von Arthritis und Haut war die ACR 20 Ansprechrate für Secukinumab 67%, für Adalimumab lag sie bei 62%, die Differenz nicht signifikant (p = 0.0719). Der primäre Endpunkt einer Überlegenheit wurde demnach nicht erreicht, jedoch eine Äquivalenz der Wirkung auf die Gelenke demonstriert.

Für den sekundären Endpunkt eines ACR50 war die Ansprechrate 49%, bzw. 45%, wiederum ohne signifikante Differenz (p = 0.2251). Der HAQ-DI Score zeigte eine hochsignifikante Besserung in beiden Gruppen, wiederum ohne Differenz. Für den PASI 90 als weiterer sekundärer Endpunkt zeigte sich eine signifikant höhere Ansprechrate von 65% gegenüber 43% (p = <0.0001) für die Secukinumab-Gruppe. Unter den explorativen Endpunkten (univariate Analyse) waren DAS28-CRP (niedrige Krankheitsaktivität), DAPSA (niedrige Krankheitsaktivität und Remission der Psoriasisarthritis) und PASI 75 und 100 Ansprechraten (Index für Hautbefall) zugunsten von Secukinumab signifikant unterschiedlich. Keine Unterschiede zeigten sich insbesondere für PASDAS-basierter Remission der Arthritis, Besserung der Daktylitis oder der Enthesitiden.
Das Sicherheitsprofil der beiden Therapeutika war konsistent mit früheren Untersuchungen[4, 5]. Die häufigsten unerwünschten Wirkungen waren Infektionen, am meisten respiratorische. Sieben schwere Infektionen wurden in der Secukinumab-Gruppe und sechs in der Adalimumab-Gruppe verzeichnet. Candida Infektionen waren in 16 (4%), bzw. 7 (2%) der Teilnehmenden vorhanden. Reaktionen an den Injektionsstellen traten in 17 Fällen (4%) der Secukinumab-Gruppe und in 47 (11%) der Adalimumab-Gruppe auf. Zwei Fälle in der Secukinumab-Gruppe erlitten schwerwiegende kardiovaskuläre Ereignisse: Zwei Teilnehmende erlitten einen Myokardinfarkt, einer mit mehreren Risikofaktoren und persistierender koronarer Herzkrankheit, und einer mit Rauchen und Hypertonie als Risikofaktoren. Ein Patient in der Adalimumab-Gruppe erlitt eine akute Herzinsuffizienz. In 2 Fällen trat unter Scukinumab ein Schub einer entzündlichen Darmerkrankung auf (einer mit Colitis ulcerosa und einer mit M. Crohn und zusätzlicher Colitis ulcerosa); neu aufgetretene entzündliche Darmerkrankungen wurden nicht registriert. Zudem wurde in der Secukinumab-Gruppe ein Todesfall auf ein Kolonkarzinom zurückgeführt und nicht in Zusammenhang mit der Therapie gesehen.
Diskussion
Dies ist die erste Head-to-Head Studie von Biologika in Psoriasis-Arthritis mit einem gelenkspezifischen primären Endpunkt, dem ACR20. Das Ausmass der Besserung der Arthritis unter Secukinumab für diesen Endpunkt ist vergleichbar mit den früheren Phase III Studien bei Psoriasis-Arthritis ohne vorangehende Exposition gegenüber TNF Inhibitoren[2, 3].
Anzumerken ist, dass in der aktuellen Studie Secukinumab in einer Dosis von 300 mg verwendet wurde, Frühere Studien haben keine signifikanten Differenzen des Ansprechens der Arthritis bei Dosis von 150 mg gegenüber 300 mg gezeigt. In der Schweiz ist die Dosis von 150 mg registriert, wobei bei ungenügender Wirkung die Erhöhung auf 300 mg erlaubt ist (die zugelassene Dosis für dermatologische Manifestationen beträgt 300 mg). Eine höhere Anzahl der Fälle in der Secukinumab Gruppe verblieb in der Studie bis zum Ende bei Woche 50 als in der Adalimumab Gruppe (371/426 (86%), respektive 338/427 (76%); Kaplan-Meier Kurve Analyse der Zeit zum Absetzen p = 0.0005).
Die Psoriasis der Haut sprach im Gegensatz zur Arthritis signifikant besser auf die Hemmung des IL-17A als auf jene des TNF an. Axiale Spondyloarthritiden bei Psoriasis-Arthritis wurden in der Studie nicht untersucht, sodass ein diesbezüglicher Vergleich nicht möglich ist. In der kürzlich publizierten MAXIMISE Studie wurden die Wirksamkeit und Sicherheit von Secukinumab bei der Behandlung axialer Manifestationen von Psoriasis-Arthritis (PsA) untersucht[9].
Die Ergebnisse der aktuellen Studie sind für Adalimumab und Secukinumab ähnlich wie jene bei den Vergleichen zwischen Adalimumab und einem anderen Il-17 A-Inhibitor, Ixekizumab[7], und dem JAK-Inhibitor Tofacitinib[8]. In der Vergleichsstudie von Adalimumab mit Ixekizumab wurde der kombinierte primäre Endpunkt aus ACR50 und PASI100 (IXE: 36%, ADA: 28%; p=0.036) erreicht. Das ACR50 Ansprechen allein hat keine Überlegenheit von Ixe versus Ada gezeigt. Die Vergleichbarkeit dieser Untersuchung mit der aktuellen Studie ist durch die Open-Label Anlage und die Kombination mit einem konventionellen Basistherapeutikum bei etwas mehr als einem Drittel der Teilnehmenden limitiert. Der sekundäre Endpunkt des ACR20 wurde von 69.6% unter Ixekizumab und 68.9% unter Adalimumab erreicht[7] Die Werte sind ähnlich wie in der hier vorliegenden doppel-blinden randomisierten Studie von McInnes et al[1]. Tofacitinib 5 mg 2 Mal täglich gegen Placebo und Adalimumab gegen Placebo wurden in einer randomisierten, prospektiven Studie mit primärem Endpunkt ACR 20 nach 3 Monaten untersucht. In der verblindeten Weiterführung wurden nach 12 Monaten praktisch identische Werte für die Psoriasis-Arthritis von Tofacitinib und von Adalimumab gegenüber Placebo festgestellt. Hier zeigte sich nach 12 Monaten keine Differenz bei den Messungen der Hautparameter in der 2 X 5 mg Tofacitinib Gruppe, deren Besserung im Rahmen des bei Adalimumab erwarteten Ausmasses lag. In dieser Studie hatten zirka 80% der Teilnehmenden eine Begleittherapie mit einem konventionellen DMARD[8], im Gegensatz zur Monotherapie mit Secukinumab in der vorliegenden EXCEED Studie.
Zusammenfassend kann festgehalten werden, dass Secukinumab und Adalimumab als Monotherapie in der ersten randomisierten, prospektiven, doppelblind kontrollierten Vergleichsstudie von biologischen oder gezielten synthetischen Basistherapeutika untersucht wurden. Für die Psoriasis-Arthritis zeigten sie nach konventionellen Basistherapeutika ein ausgezeichnetes, gleichwertiges Wirkungsprofil, wobei die Retentionsrate für Secukinumab höher lag. Für die kutanen Manifestationen wurde ein signifikanter Vorteil für die Anwendung von Secukinumab festgestellt. Es bleibt abzuwarten, wie die Daten in ähnlich angelegten Studien der anderen Medikationen aussehen.
Referenzen
- McInnes IB, Behrens F, Mease PJ, Kavanaugh A, Ritchlin C, Nash P, et al. Secukinumab versus adalimumab for treatment of active psoriatic arthritis (EXCEED): a double-blind, parallel-group, randomised, active-controlled, phase 3b trial. Lancet. 2020;395(10235):1496-505.
- Mease PJ, McInnes IB, Kirkham B, Kavanaugh A, Rahman P, van der Heijde D, et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med. 2015;373(14):1329-39.
- Kavanaugh A, Mease PJ, Reimold AM, Tahir H, Rech J, Hall S, et al. Secukinumab for Long-Term Treatment of Psoriatic Arthritis: A Two-Year Followup From a Phase III, Randomized, Double-Blind Placebo-Controlled Study. Arthritis Care Res (Hoboken). 2017;69(3):347-55.
- McInnes IB, Mease PJ, Kirkham B, Kavanaugh A, Ritchlin CT, Rahman P, et al. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015;386(9999):1137-46.
- Mease PJ, Ory P, Sharp JT, et al. Adalimumab for long-term treatment of psoriatic arthritis: 2-year data from the adalimumab effectiveness in psoriatic arthritis trial (ADEPT). Ann Rheum Dis 2009; 68: 702–09.
- Bissonnette R, Luger T, Thaçi D, Toth D, Lacombe A, Xia S, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate-to-severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol. 2018;32(9):1507-14.
- Smolen JS, Mease P, Tahir H, Schulze-Koops H, de la Torre I, Li L, et al. Multicentre, randomised, open-label, parallel-group study evaluating the efficacy and safety of ixekizumab versus adalimumab in patients with psoriatic arthritis naïve to biological disease-modifying antirheumatic drug: final results by week 52. Ann Rheum Dis. 2020;79(10):1310-9.
- Mease P, Hall S, FitzGerald O, van der Heijde D, Merola JF, Avila-Zapata F, et al. Tofacitinib or Adalimumab versus Placebo for Psoriatic Arthritis. N Engl J Med. 2017;377(16):1537-50.
- Baraliakos, Xenofon, et al. „Secukinumab in patients with psoriatic arthritis and axial manifestations: results from the double-blind, randomised, phase 3 MAXIMISE trial.“ Annals of the Rheumatic Diseases (2020).
Mit freundlicher Unterstützung von:


Novartis Pharma Schweiz AG, Suurstoffi 14, 6343 Rotkreuz
Die GUSTO-Studie
29. November 2021
Video-Dauer: 5:15 Minuten

